Erytrocytten – en spesialisert celle for transport
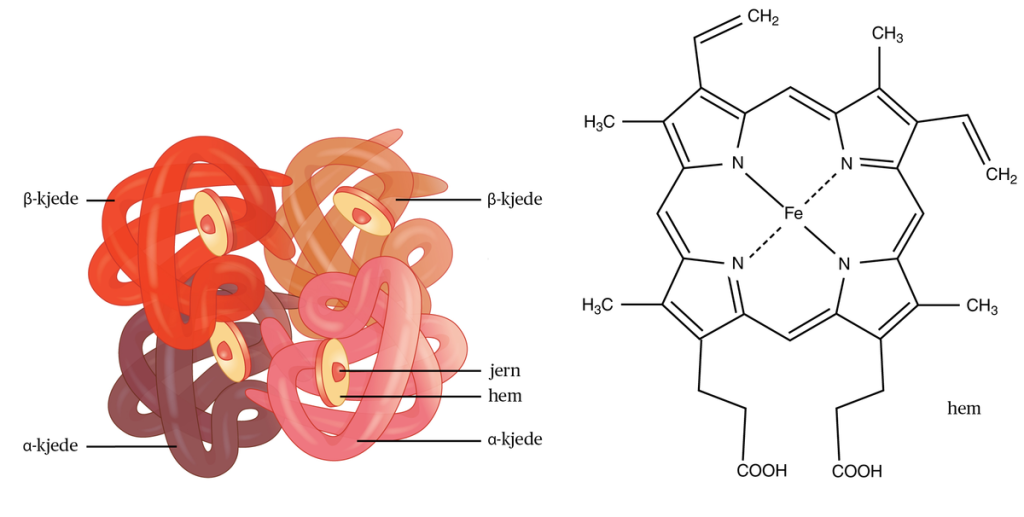
Hemoglobin er det sentrale proteinet i erytrocyttene, og står for transporten av oksygen fra lungene til kroppens vev, samt delvis transport av karbondioksid tilbake til lungene. Molekylet er et tetramert protein, bestående av fire polypeptidkjeder: to alfa-kjeder og to beta-kjeder i voksen hemoglobin (HbA). Hver av disse kjedene har bundet en hemgruppe, som inneholder et jernatom (Fe²⁺) i sentrum.
Erytrocytten er kroppens mest tallrike celle og spiller en avgjørende rolle i oksygentransport og gassutveksling. Dens unike struktur gjenspeiler dens funksjon. Erytrocytten er bikonkav i form – altså flattrykt i midten – med en diameter på omtrent 7–8 mikrometer og en tykkelse på rundt 2 mikrometer. Denne formen er ikke tilfeldig. Den gir en optimal overflate-til-volum-ratio for effektiv gassutveksling og tillater cellen å presse seg gjennom trange kapillærer uten å sprekke.
En egenskap ved erytrocytter er at de mangler kjerne. Dette skjer i løpet av modningen i benmargen og gir rom for et høyt innhold av hemoglobin, som utgjør ca. 95 % av tørrvekten. Hemoglobin er selve motoren bak oksygentransporten.
Cellemembranen er rik på polysakkarider og glykoproteiner – blant annet de strukturene som bestemmer blodtypen (AB0 og Rh-systemet). Under membranen ligger et subkortikalt cytoskjelett, som er bygd opp av proteiner som spektrin, aktin og ankyrin. Dette gir erytrocytten mekanisk stabilitet og elastisitet, slik at den kan tåle deformasjon under passasje gjennom mikrosirkulasjonen.
Erytrocytten har ikke mitokondrier og er derfor helt avhengig av anaerob glykolyse for energiproduksjon. Den har heller ingen organeller for proteinsyntese. Når cellen eldes og mister funksjon, fjernes den av fagocytose – hovedsakelig i milten – etter en levetid på omtrent 120 dager.
Erytrocyttens metabolisme
Erytrocytter er unike celler som må produsere all energien sin uten tilgang på mitokondrier. Dette betyr at de er helt avhengige av anaerob glykolyse for å skaffe ATP – den energien som trengs for å opprettholde ionebalanse, formegenskaper og membranstabilitet. Alt dette er avgjørende for at cellen skal kunne sirkulere i blodbanen i opptil 120 dager.
I tillegg til glykolysen har erytrocyttene et eget sideveissystem – pentosefosfatveien (hexosemonofosfat-shunten).
Her produseres NADPH, som er nødvendig for å redusere oksidert glutathion. Glutathion fungerer som en kraftig antioksidant og beskytter cellen mot oksidativt stress – altså skade fra frie radikaler.
Uten denne beskyttelsen ville erytrocyttene lett bli ødelagt.
En annen viktig prosess er reduksjon av methemoglobin.
Methemoglobin inneholder jern i Fe³⁺-form og kan ikke binde oksygen.
NADH produseres under glykolysen og brukes til å redusere methemoglobin tilbake til funksjonelt hemoglobin med jern i Fe²⁺-form.
Erytrocytter produserer også et molekyl kalt 2,3-difosfoglyserat (2,3-DPG).
Dette stoffet binder seg til hemoglobin og modulerer oksygenaffiniteten, altså hvor lett eller vanskelig hemoglobin slipper oksygen.
Når 2,3-DPG øker – for eksempel ved hypoksi eller anemi – senkes affiniteten, og oksygen frigis lettere i vevet. Dette er en elegant mekanisme for å tilpasse oksygentransporten til kroppens behov.
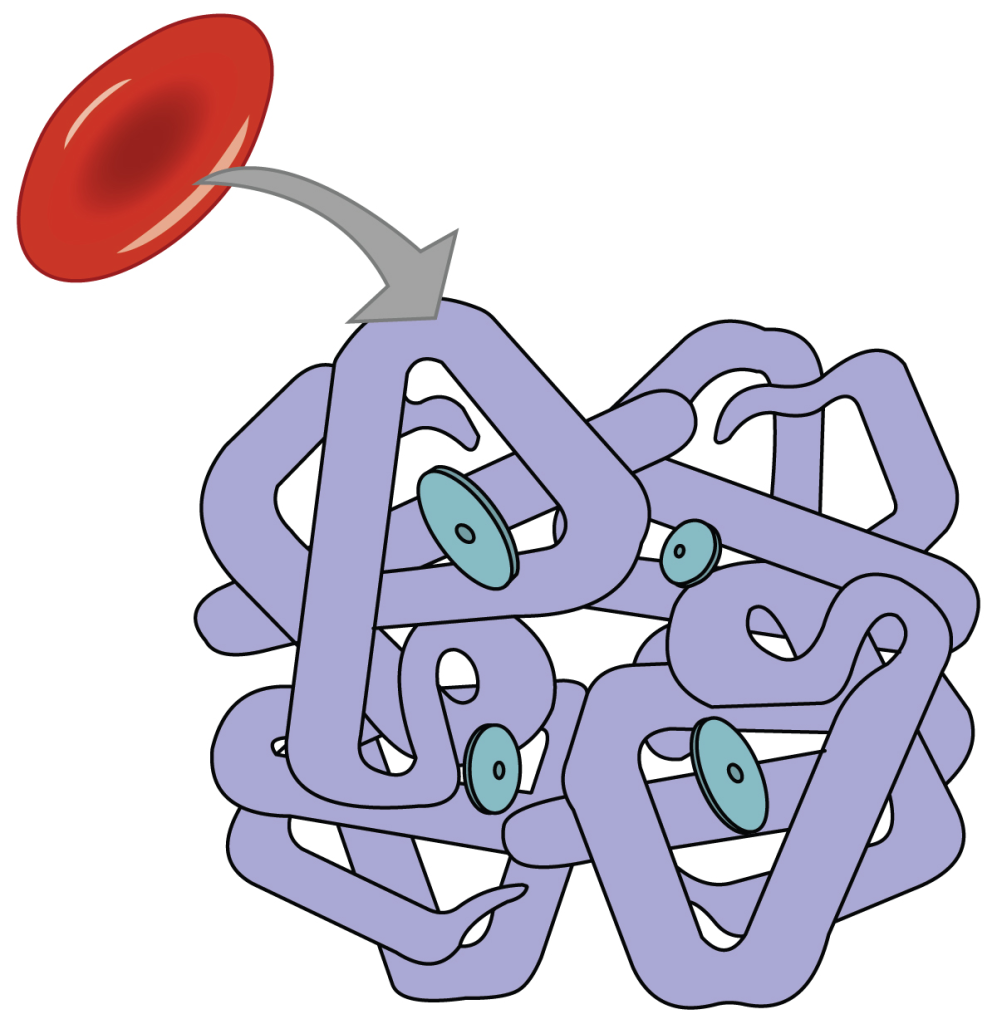
Erytrocyttens cytoskjelett – strukturen bak den bikonvekse formen
Erytrocytter har en helt spesiell form – de er tynne i midten og tykkere i kanten, altså bikonkave.
Dette gir dem en stor overflate i forhold til volum, noe som er ideelt for gassutveksling. Samtidig gjør formen dem fleksible nok til å presse seg gjennom trange kapillærer. Men hva er det som gir og opprettholder formen?
Svaret ligger i cytoskjelettet, et fleksibelt og sofistikert nettverk like under cellemembranen. Dette nettverket består av proteiner som spektrin, aktin, ankyrin, tropomyosin, band 3 og adducin, som sammen sørger for elastisitet, stabilitet og evne til å gå tilbake til sin opprinnelige form etter deformasjon.
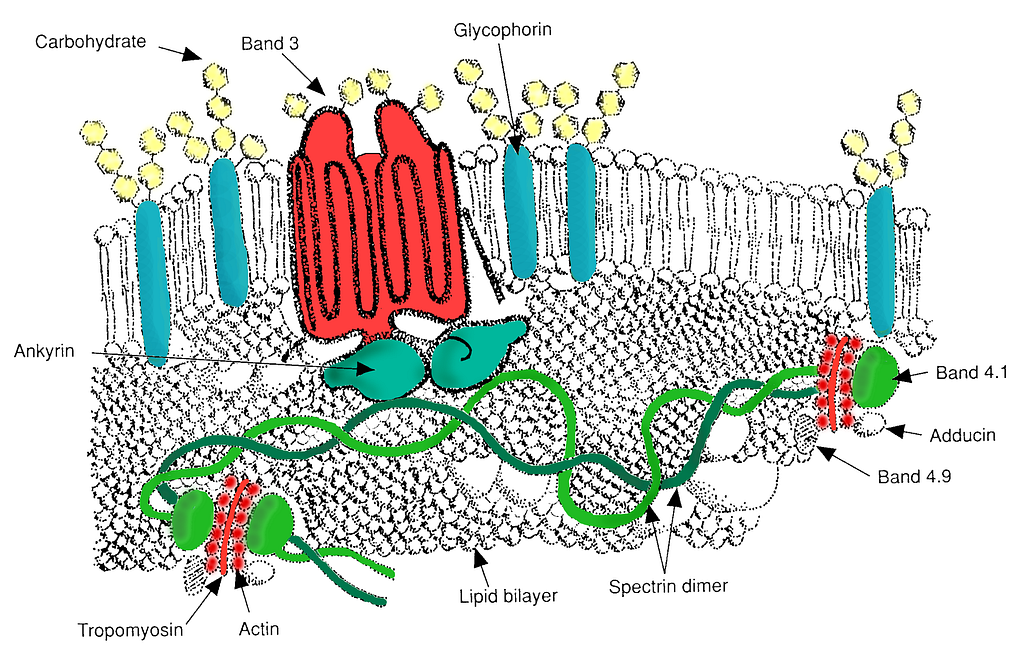
Spektrin er et nøkkelprotein og danner lange filamenter som kobles sammen i et nettverk via kortere aktintråder. Dette nettverket festes til cellemembranen gjennom forankringskomplekser som inneholder blant annet band 3 og ankyrin. Band 3 er spesielt viktig fordi det både inngår i membranforankringen og i transport av bikarbonat og klorid – altså også en del av CO₂-transporten i blodet.
Dersom det oppstår mutasjoner i disse cytoskjelettproteinene, kan formen og stabiliteten til erytrocyttene bli forstyrret. Dette skjer for eksempel ved:
- Hereditær sfærocytose: erytrocyttene blir mer kuleformede og mindre fleksible
- Hereditær elliptocytose: erytrocyttene blir ovale eller elliptiske
Begge tilstandene gjør erytrocyttene mer utsatt for nedbrytning i milten, og gir opphav til hemolytisk anemi.
Hemoglobinsyntese – hvordan røde blodceller blir oksygentransportører
Hemoglobin utgjør rundt 95 % av erytrocyttens tørrvekt og er det som gir cellen dens funksjon og farge. Syntesen av hemoglobin starter tidlig i erytropoesen, nærmere bestemt i proerytroblasten, og fullføres i ortokromatisk erytroblast – altså før cellen kvitter seg med kjernen og blir en retikulocytt.
Hemoglobin består av to hoveddeler: globin (proteindelen) og heme (jernholdig porfyrinring). Disse to delene produseres parallelt og må tilpasses nøyaktig for at sluttproduktet skal fungere.
Globindelen – genetikken bak hemoglobinkjeder
Globinproteinet består av fire kjeder: vanligvis to alfa- og to betakjeder hos voksne (HbA₁). Disse dannes ut fra gener på:
- Kromosom 16 for alfa-kjeder (det finnes fire gener – to fra hvert kromosom)
- Kromosom 11 for beta-kjeder (to gener totalt – ett fra hver forelder)
Mutasjoner i disse genene kan føre til:
- Kvantitative feil – redusert produksjon (f.eks. talassemier)
- Kvalitative feil – endret aminosyresekvens (f.eks. sigdcelleanemi)
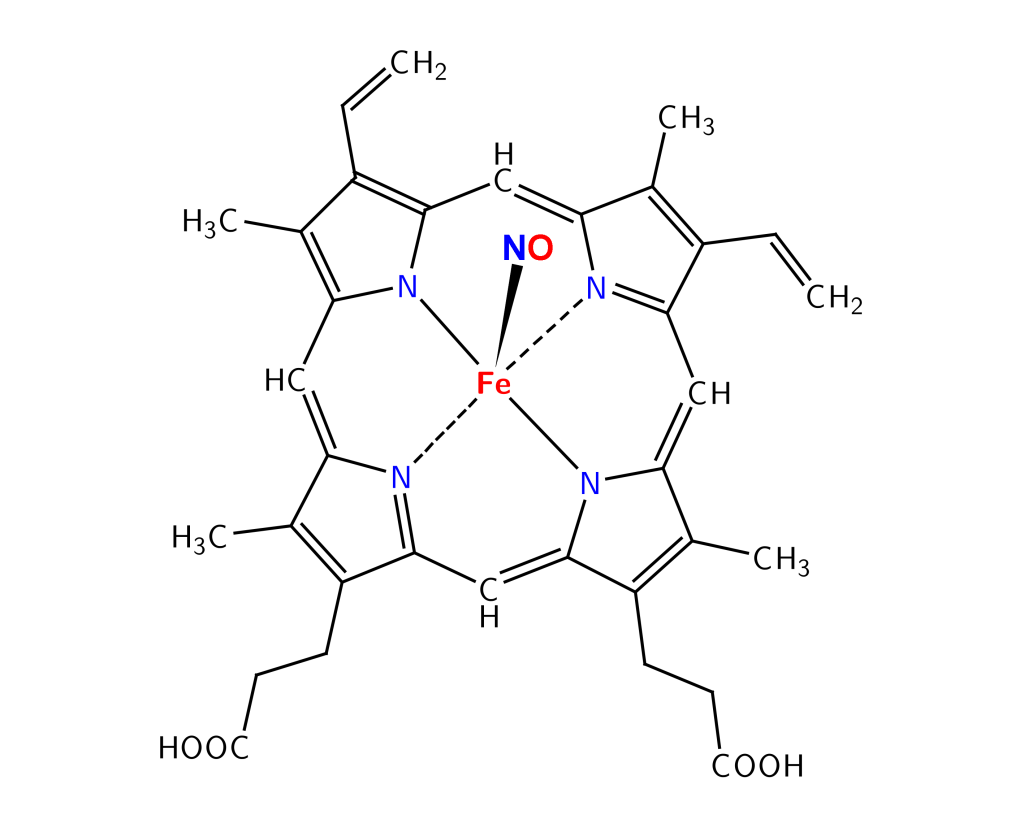
Heme – porfyrinring med jern i sentrum
Heme produseres i både mitokondrier og cytosol i erytroblastene, og består av en porfyrinring med et sentralt Fe²⁺-atom. Dette jernet binder oksygen reversibelt. Prosessen er kompleks og krever mange enzymer. Ved defekter i noen av enzymene, kan det hope seg opp mellomprodukter – noe som gir opphav til porfyrisykdommer.
Nedbrytning av hemoglobin
Når erytrocytter blir gamle (levetid ~120 dager), fagocyteres de i milt, lever og benmarg. Da skjer:
- Globin brytes ned til aminosyrer og resirkuleres.
- Heme deles i:
- Jern, som lagres som ferritin eller brukes på nytt.
- Biliverdin → bilirubin, som transporteres til leveren og skilles ut i gallen.
Med andre ord: kroppen gjenbruker det meste, og hemoglobinsyklusen er en elegant balanse mellom produksjon, funksjon og resirkulering.
Hemoglobinvarianter og funksjonell betydning
Hemoglobin er ikke én enkelt type molekyl – det finnes flere varianter med ulik sammensetning og funksjon, tilpasset ulike faser i livet eller genetiske forhold. De ulike variantene dannes ved at forskjellige globinkjeder kombineres med heme.
Føtal hemoglobin – HbF
Hos fosteret dominerer HbF, som består av:
- To alfa-kjeder
- To gamma-kjeder
HbF har høyere affinitet for oksygen enn voksent hemoglobin. Det er viktig fordi fosteret må trekke oksygen fra morens blod gjennom placenta. Etter fødsel skiftes HbF gradvis ut med HbA₁.
Voksent hemoglobin – HbA₁
Dette er den vanligste formen hos voksne:
- To alfa-kjeder
- To beta-kjeder
HbA₁ står for nesten all oksygentransport i en frisk voksen.
Varianthemoglobin og kliniske hemoglobinopatier
Hemoglobin finnes ikke bare i én form. Selv om HbA (alfa₂beta₂) er det vanligste hos friske voksne, finnes det også andre varianter med litt annerledes sammensetning. HbA₂ (alfa₂delta₂) er en slik naturlig variant, og utgjør vanligvis mindre enn 3,5 % av totalt hemoglobin. Denne formen er ikke sykdomsforbundet i seg selv, men nivået kan være økt ved visse tilstander, for eksempel ved beta-thalassemi. Slike variasjoner i hemoglobinsammensetning er viktige både for diagnostikk og forståelse av hemoglobinopatier.
HbS – sigdcellehemoglobin
HbS oppstår som følge av en punktmutasjon i beta-globingenet, der én enkelt aminosyre (glutamat) er byttet ut med valin i posisjon 6. Denne lille genetiske endringen har store konsekvenser: Når oksygennivået i blodet faller (for eksempel under fysisk aktivitet, infeksjon eller i høyden), tenderer HbS til å klumpe seg sammen (polymerisere) inne i erytrocyttene.
Resultatet er at cellene mister sin fleksible, runde form og i stedet blir lange og halvmåneformede – det vi kaller sickle-celler. Disse deformerte cellene kan ikke bevege seg like godt i mikrosirkulasjonen og kan blokkerer små blodkar, noe som gir smerte, infarkt og organskade. Tilstanden kalles sigdcelleanemi, og er mest alvorlig når man er homozygot for HbS (HbSS), men kan også gi sykdom i kombinasjon med andre varianter som HbC eller beta-thalassemi.
HbC – en mildere variant
HbC skyldes også en punktmutasjon i beta-globingenet, men her byttes glutamat ut med lysin i samme posisjon (posisjon 6). Denne endringen gjør ikke at hemoglobinet polymeriserer på samme måte som HbS, men det gir en redusert løselighet og gjør erytrocyttene litt mer skjøre.
HbC gir vanligvis en mild hemolytisk anemi, og symptomene er ofte fraværende hos heterozygote. I kombinasjon med HbS (HbSC) kan det derimot gi en moderat form for sigdcellesykdom.
HbE – vanlig i Asia
HbE skyldes en mutasjon i beta-globingenet som både endrer aminosyren og fører til unormal spleising av mRNA. Det gjør at mindre beta-globin produseres. HbE finnes særlig i Sørøst-Asia, og mange som har én kopi (heterozygote) er asymptomatiske. I homozygot form gir det mild mikrocytær anemi, og i kombinasjon med beta-thalassemi kan det gi alvorlig sykdom.
Talassemier
Skyldes nedsatt produksjon av alfa- eller betakjeder:
- Alfa-talassemi: Mangler ett eller flere av de fire alfa-globingenene:
- 1 mutasjon: tyst bærer
- 2 mutasjoner: mild anemi
- 3 mutasjoner: HbH-sykdom (overskudd av betakjeder)
- 4 mutasjoner: Hb Barts (kun gamma-kjeder) – dødelig
- Beta-talassemi: Redusert eller fraværende produksjon av betakjeder → overskudd av alfa-kjeder → ineffektiv erytropoiese og anemi
Disse variantene påvirker oksygenaffinitet, celleform og levetid til erytrocyttene, og har stor klinisk betydning – både i diagnostikk og behandling.
Hemoglobinets funksjon og gassutveksling
Hemoglobin spiller en sentral rolle i kroppens evne til å transportere oksygen fra lungene til vev, og karbondioksid tilbake fra vev til lungene.
Hemoglobinets affinitet for oksygen er ikke konstant, men påvirkes av flere faktorer. Dette gjør det mulig for hemoglobinet å tilpasse seg kroppens behov.
I lungene, hvor oksygentrykket (pO₂) er høyt og miljøet er mer basisk, binder hemoglobin oksygen svært effektivt.
I vevet, der pO₂ er lavere, pH er lavere (mer surt) og CO₂-nivåene er høyere, slipper hemoglobinet lettere fra seg oksygenet.
Dette fenomenet kalles Bohr-effekten, og er helt avgjørende for effektiv oksygentransport.
Hemoglobin har også en kooperativ bindingsmekanisme.
Når et oksygenmolekyl binder seg til én hemgruppe, øker affiniteten for oksygen i de tre andre bindingssetene – dette gir den karakteristiske sigmoidale (S-formede) oksygenmetningskurven.
Motsatt skjer det samme ved frigjøring – når ett oksygenmolekyl slipper taket, blir det lettere for de andre å løsne. Dette gir hemoglobinet en svært effektiv tilpasningsevne, både ved høyt og lavt oksygentrykk.
I tillegg til oksygen, transporterer hemoglobin også en betydelig andel av karbondioksidet som dannes i vevet. Omtrent 10 % bindes direkte til globinkjedene i hemoglobinet og danner såkalte karbaminoforbindelser.
Denne bindingen skjer lettere når oksygen er fraværende, noe som kalles Haldane-effekten – det vil si at hemoglobin som har gitt fra seg oksygen, har høyere affinitet for CO₂. De resterende 90 % av CO₂ transporteres enten som løst gass i plasma eller omdannes til bikarbonat i erytrocyttene.
Oksygenets dissosiasjonskurve
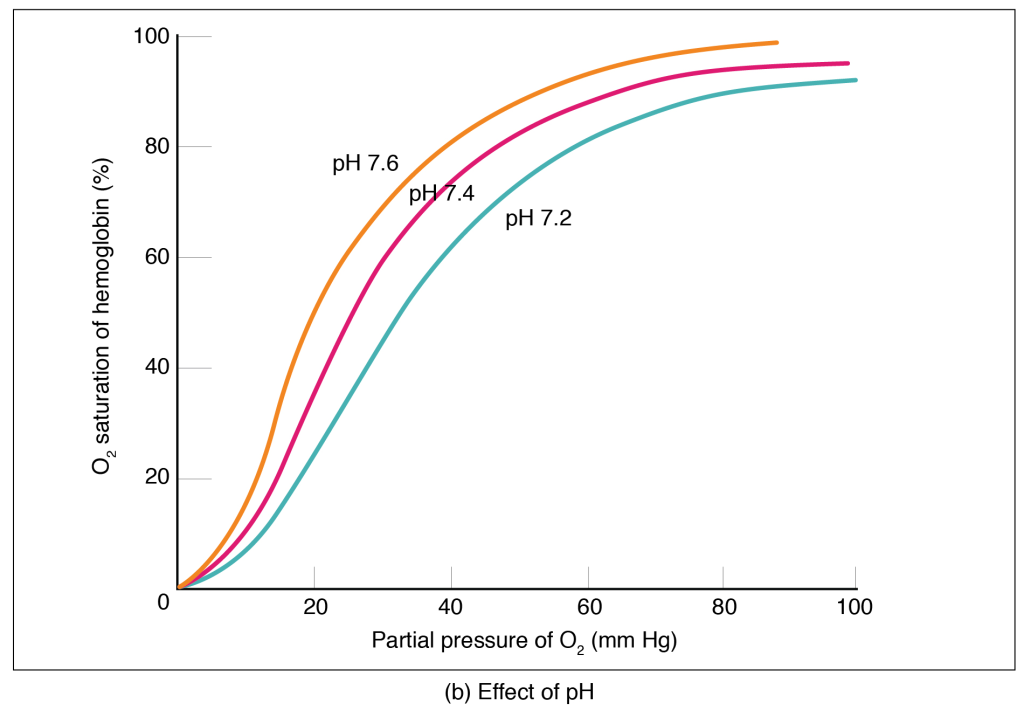
Dette leder oss da til oksygenets dissasosiasjonskurve.
Venstreforskyvning = Økt affinitet
Når kurven forskyves mot venstre, betyr det at hemoglobin holder oksygenet tettere, og frigis vanskeligere. Dette skjer f.eks. ved:
- Lav temperatur
- Lav 2,3-DPG (difosfoglyserat)
- Høy pH (alkalose)
- Tilstedeværelse av karbonmonoksid (CO)
Dette kan være gunstig i lungene, men hindrer frigjøring i vev.
Høyreforskyvning = Redusert affinitet
Når kurven forskyves mot høyre, reduseres oksygenaffiniteten. Hemoglobin slipper oksygenet lettere – ideelt i arbeidende vev med stort behov for oksygen. Høyreforskyvning skyldes:
- Økt temperatur
- Økt 2,3-DPG (typisk ved anemi og hypoksi)
- Lav pH (acidose, f.eks. ved mye CO₂)
Dette gjør det lettere for hemoglobinet å frigjøre oksygen akkurat der det trengs mest – en viktig del av kroppens autoregulering.
Spesielle hemoglobinvarianter og kurveskift
- HbF (føtalt hemoglobin) har høyere O₂-affinitet → kurven er venstreforskjøvet. Dette er viktig for at fosteret skal kunne hente oksygen fra mors blod via placenta, også i et miljø med lavere pO₂.
- HbS (sigdcellehemoglobin) har lavere O₂-affinitet → kurven er høyreforskjøvet. Dette gjør at oksygen lettere frigis i vev, og det antas at dette delvis forklarer hvorfor anemi tåles bedre hos pasienter med sigdcelleanemi.
Trombopoiesen – produksjon av blodplater
Regulering og signaler
Trombopoiesen er prosessen der trombocytter (blodplater) dannes fra stamceller i benmargen. Hovedhormonet som styrer denne prosessen er trombopoietin (TPO). Det produseres hovedsakelig i leveren, men også i nyrene og benmargen i mindre grad. TPO virker på både stamceller og forløpere til megakaryocytter og fremmer både vekst, modning og plateproduksjon.
Inflammatoriske cytokiner som IL-6 og IL-11 kan også øke trombocytopoesen ved å stimulere TPO-uttrykk – noe vi ser ved infeksjoner og betennelsestilstander hvor behovet for koagulasjon og vevsreparasjon er høyere.
Fra stamcelle til trombocytt
Prosessen starter med hematopoietiske stamceller som gjennom flere differensieringstrinn blir til megakaryocytt-forløpere (MKC-CFU). Disse forløperne modnes videre til megakaryocytter (MKC) – de største cellene i benmargen. En enkelt megakaryocytt kan produsere over 3000 trombocytter. Du kan lese mer om dette her.
Trombocytter – struktur og funksjon
Oppbygning og egenskaper
Trombocytter er kjernefrie, små (2–3 µm), flate (diskoide) celler som sirkulerer i blodet. De har kontraktile elementer (aktin og myosin) som gjør at de kan endre form raskt ved aktivering – en egenskap avgjørende for deres rolle i koagulasjon. Overflaten er tett besatt med reseptorer for blant annet kollagen, fibrinogen, ADP og trombin.
Inni trombocyttene finner vi:
- Mitokondrier (selv om de er kjernefrie!)
- Alfagranula: inneholder koagulasjonsfaktorer, vekstfaktorer, adhesjonsproteiner (f.eks. vWF, fibrinogen).
- Dense-bodies: inneholder ADP, ATP, serotonin og kalsium – viktige signalmolekyler for aktivering.
Levetiden til en trombocytt er rundt 10 dager. Deretter fjernes den hovedsakelig av makrofager i milt og lever.
Trombocytters rolle i hemostasen
Primær hemostase – Trombocyttenes førstelinjeforsvar
Når et blodkar skades, enten ved et kutt, traume eller mikroskopisk rift i endotelet, starter kroppen umiddelbart prosessen med å stoppe blødningen. Denne prosessen kalles hemostase, og den skjer i flere faser. Primær hemostase er den første og raskeste delen – og den handler om trombocytter, også kjent som blodplater.
Men hva betyr egentlig primær hemostase?
Tenk deg at en liten blodåre sprekker. Det første kroppen må gjøre, er å tette lekkasjen midlertidig. Dette skjer ved at trombocytter samles og danner en slags «plasterlapp» over skaden. Denne kalles en plateplugg – og det er selve kjernen i primær hemostase.
La oss ta det steg for steg:
1. Karskade og blottlagt kollagen
Når karveggen skades, blir kollagen og andre strukturer i det subendoteliale vevet eksponert. Disse strukturene er vanligvis skjult, så immun- og blodceller gjenkjenner dette som et faresignal.
Samtidig frigjøres von Willebrands faktor (vWF), som er et viktig limmolekyl i denne prosessen. vWF finnes allerede i blodet og i endotelceller og binder seg nå raskt til det eksponerte kollagenet.
2. Adhesjon – trombocyttene fester seg
Frie trombocytter i blodet har reseptorer på overflaten – blant annet GpIb (glycoprotein Ib). Når de passerer det skadede området, gjenkjenner GpIb reseptoren vWF som nå er bundet til kollagenet. Dette fører til at trombocyttene fester seg til skadestedet – en prosess kalt adhesjon.
3. Formendring og aktivering
Etter at trombocyttene har festet seg, aktiveres de. Dette utløser en dramatisk formendring: fra små, glatte skiver til stjerneformede celler med utløpere. Trombocyttene blir nå «klebrige», og klare til å samarbeide.
4. Degranulering – signaler sendes ut
Aktiverte trombocytter tømmer innholdet i små vesikler – kalt granula – som de har lagret på forhånd. Dette inkluderer:
- ADP, som gjør andre trombocytter mer mottakelige for aktivering.
- Tromboxan A₂ (TXA₂), som virker både sammentrekkende på blodkar og rekrutterende på trombocytter.
- Serotonin, som også bidrar til vasokonstriksjon (sammentrekning av blodkaret).
5. Rekruttering og aggregering
Nye trombocytter i nærheten responderer på signalene, aktiveres og blir også klebrige. En viktig reseptor aktiveres nå: GpIIb/IIIa. Denne reseptoren binder fibrinogen, som fungerer som en bro mellom flere trombocytter. Resultatet er at trombocyttene binder seg til hverandre og klumper seg sammen.
Denne prosessen kalles aggregering, og det dannes en midlertidig plateplugg over skaden.
Leukocytter og granulopoiese
Leukocytter, også kjent som hvite blodceller, utgjør kroppens indre forsvarsstyrke. De sirkulerer i blodet, men kan raskt forlate blodbanen for å oppsøke vev der de bekjemper infeksjoner eller fjerner skadet vev. Leukocytter deles inn i fem hovedtyper, hvorav tre av dem er granulocytter: nøytrofile, eosinofile og basofile. De to andre er monocytter og lymfocytter. Felles for granulocyttene er at de har synlige granula (korn) i cytoplasmaet ved mikroskopi.
Regulering av granulopoiese – produksjon av granulocytter
Produksjonen av granulocytter i benmargen, kalt granulopoiese, styres av ulike cytokiner og vekstfaktorer. Viktige stimulatorer inkluderer SCF (stem cell factor), GM-CSF (granulocyte-macrophage colony-stimulating factor), G-CSF (granulocyte colony-stimulating factor) og interleukin 3 (IL-3). Disse stoffene stimulerer stamceller i benmargen til å differensiere mot granulocyttlinjen, spesielt nøytrofile.
Laktroferrin, som finnes i granula i modne granulocytter, fungerer som en negativ regulator. Når konsentrasjonen av nøytrofile stiger i blodet, vil økt mengde laktroferrin signalisere til benmargen om å bremse produksjonen – et slags innebygd feedback-system.
Granulopoiese følger en rytmisk livssyklus:
- Produksjon i benmargen: ca. 5 dager
- Lagring i benmargens reservelager: ca. 5 dager
- Sirkulasjonstid i blodet: rundt 10 timer
- Opphold i vev etter migrasjon: 1 døgn eller mer
I tillegg til de granulocyttene som flyter fritt i blodet, finnes det også en stor andel som er “adhert” til karveggen – et slags reservelager som kan mobiliseres ved behov.
Ved infeksjon eller annen stimulans kan granulopoiesen mangedobles – produksjonen kan faktisk øke opptil 10 ganger innen få døgn.
Nøytrofile granulocytter – kroppens frontlinje
Blant leukocyttene er nøytrofile granulocytter de klart mest tallrike – de utgjør vanligvis mellom 50 og 70 % av alle hvite blodceller hos en frisk voksen person. De er spesielt viktige i det vi kaller det medfødte immunforsvaret, altså den delen av immunsystemet som reagerer raskt og uspesifikt på trusler, uten å “huske” dem.
Sammen med monocytter og andre fagocytter utgjør de det såkalte 2. linjeforsvaret, som aktiveres etter at kroppens fysiske og kjemiske barrierer – som hud og slimhinner – er brutt.
Størrelse og utseende
Nøytrofile granulocytter er runde celler med en diameter på 10–12 mikrometer. De har en karakteristisk kjerne med 2–5 segmenter, forbundet med tynne tråder – en form som gjør dem smidige og i stand til å bevege seg raskt gjennom trange kapillærer og inn i vev.
Cytoplasmaet er fullt av granula – små “pakker” med stoffer som er viktige for mikrobedrap. De inneholder blant annet:
- Myeloperoksidase (MPO): et enzym som danner giftige oksygenradikaler
- Laktroferrin: binder jern og hindrer bakterievekst
- Proteolytiske enzymer som bryter ned mikrober og vev
Nøytrofile granulocytter – spesialister i mikrobedrap
Nøytrofile er kroppens fagocytose-spesialister. Det betyr at de er laget for å “spise” og drepe mikroorganismer. Dette skjer både ved:
- Intracellulært mikrobedrap – via fagocytose og nedbrytning i lysosomer
- Ekstracellulært mikrobedrap, enten gjennom:
- Exocytose/degranulering: utskillelse av giftige stoffer
- NETose: en spesiell form for celledød der cellen sprekker og frigjør nettverk av DNA og antimikrobielle proteiner som fanger bakterier
Jeg kommer straks tilbake til NETose mer i detalj.
Granulocyttenes ferd til skadestedet – hvordan nøytrofile vet hvor de skal
Når det oppstår en infeksjon eller vevsskade, må nøytrofile granulocytter raskt finne veien dit. Dette skjer gjennom en nøye koordinert prosess som starter i blodårene og ender ute i vevet, der mikrober eller skadet vev venter. Denne reisen deles inn i tre hovedfaser:
Marginalisering
Granulocyttene flyter vanligvis midt i blodstrømmen, men ved betennelse ruller de langs innsiden av blodkarets endotel, i det vi kaller marginalisering. Dette skjer takket være selektiner, en type adhesjonsmolekyler uttrykt på overflaten av endotelcellene som fanger granulocyttene.
Adhesjon
Etter å ha blitt fanget opp, stopper granulocyttene helt opp og fester seg mer permanent til karveggen. Dette skjer ved hjelp av integriner, en annen type adhesjonsmolekyler som aktiveres av signalstoffer (cytokiner) i området.
Diapedese (transmigrasjon)
Så beveger granulocyttene seg gjennom porer i kapillærveggen og ut i vevet. Dette styres av blant annet kalsium og tiltrekkes av kjemotaksiner – signalstoffer som mikrober og skadet vev sender ut som en slags “duftsti”.
Kjemotakse
Hele denne prosessen – fra marginalisering til diapedese – kalles kjemotakse, og gjør at nøytrofile granulocytter kan nå frem til skadestedet i løpet av få minutter.
Fagocytose – hvordan nøytrofile granulocytter sluker og dreper mikroorganismer
Nøytrofile granulocytter er blant kroppens mest effektive soldater i kampen mot bakterier og sopp. De er spesialister i en prosess som kalles fagocytose, som betyr at cellen bokstavelig talt spiser det som truer kroppen. Dette skjer i flere koordinerte trinn, og hver del av prosessen er nøye regulert og tilpasset for å sikre effektiv mikrobedrap.
Alt starter med at den nøytrofile granulocytten oppdager et signal om skade eller infeksjon. Kjemiske signalstoffer i vevet, kjent som kjemokiner, trekker til seg nøytrofile fra blodbanen og leder dem frem til stedet der de trengs. Når de er fremme, gjenkjenner de mikroorganismene ved hjelp av spesialiserte reseptorer på celleoverflaten.
Disse reseptorene inkluderer blant annet:
- Pattern Recognition Receptors (PRRs), som gjenkjenner mønstre som er typiske for mikroorganismer (slik som bakterie-DNA eller celleveggkomponenter).
- Komplementreseptorer, som binder til mikrober som allerede er merket av kroppens komplementproteiner.
- Fc-reseptorer, som binder til antistoffer (vanligvis IgG) som har festet seg til mikroben – en prosess kalt opsonisering. Dette gjør mikroben «dekorert» og lettere å fange og spise.
Når den nøytrofile granulocytten har bundet seg til mikroben, omfavner den sitt bytte ved å omslutte det med cellemembranen. Mikroben trekkes deretter inn i cellen og plasseres i en membranavgrenset blære kalt et fagosom.
Fagosomet fusjonerer raskt med små vesikler i cellen kalt lysosomer, som inneholder kraftige enzymer og giftige molekyler. Sammensmeltingen danner et fagolysosom, og her starter selve mikrobedrapet.
I fagolysosomet aktiveres flere dødelige mekanismer:
- Det dannes reaktive oksygenradikaler (ROS), som er svært ustabile molekyler som skader mikrobenes proteiner, lipider og DNA. Enzymet myeloperoksidase (MPO) er viktig i denne prosessen.
- Det frigjøres laktroferrin, som binder jern og dermed hindrer bakterievekst, siden mange bakterier er avhengige av jern.
- Samtidig frigjøres cytokiner, som varsler og aktiverer andre deler av immunforsvaret.
- Lysosomale enzymer bryter ned mikroben bit for bit.
Når mikroben er død og nedbrutt, vil celleinnholdet enten resirkuleres av fagocytten eller presenteres for andre immunceller, som ledd i det adaptive immunforsvaret.
Gjennom denne prosessen spiller nøytrofile en avgjørende rolle i kroppens førstelinjeforsvar mot infeksjoner. Deres evne til å gjenkjenne, sluke og nøytralisere mikroorganismer på få minutter gjør dem til noen av immunsystemets mest effektive verktøy.
NETose – når nøytrofile ofrer seg for å fange og drepe mikroorganismer
Nøytrofile granulocytter er ikke bare i stand til å fagocytere og drepe mikrober på egen hånd – i ekstreme situasjoner har de også en måte å ofre seg selv for å beskytte kroppen. Denne prosessen kalles NETose, og navnet kommer fra neutrophil extracellular traps (NETs) – altså nett som nøytrofile kaster ut over angripere.

NETose er en form for programmert celledød, men i motsetning til apoptose (som er stille og ryddig) er NETose dramatisk og eksplosiv. Når en nøytrofil aktiveres kraftig, for eksempel ved tilstedeværelse av bakterier, sopp eller proinflammatoriske signaler, kan den gjennomgå en serie endringer som til slutt gjør at den “sprenges” og slipper ut sitt DNA i omgivelsene. Men dette DNA-et slippes ikke ut uten hensikt – det danner lange, klebrige nettverk som fungerer som en fysisk barriere.
NETose er særlig effektiv mot mikrober som er for store eller for mange til å fagocyteres. Det fungerer som en fysisk felle og samtidig som et giftlager. Prosessen er en del av kroppens medfødte immunforsvar, og aktiveres ofte tidlig ved infeksjon.
Men – det finnes en bakside. NETs kan også skade kroppens eget vev dersom de ikke fjernes raskt, og de har blitt koblet til flere autoimmune og inflammatoriske sykdommer, som lupus og vaskulitt.
Monocytter og makrofager
Monocytter er en type hvite blodceller som sirkulerer i blodet i kun 1–2 døgn før de migrerer ut i vevet og modnes videre til makrofager – kroppens profesjonelle “stor-spisere”. Monocyttene har flere viktige funksjoner: de deltar i kjemotaksi (målrettet vandring mot signaler fra skadested), fagocyterer mikrober og cellerester, og fungerer som antigenpresenterende celler.
Når de går over til makrofager i vevet, får de et langt liv og tilpasser seg vevet de befinner seg i. Eksempler på spesialiserte makrofager er Kupffer-celler i leveren, benmargsmakrofager, mikroglia i sentralnervesystemet og alveolære makrofager i lungene.
Monocytter og makrofager er spesielt viktige i forsvar mot intracellulære mikrober og aktiveres særlig ved subakutte og kroniske infeksjoner.
De spiller en sentral rolle i immunregulering, blant annet ved å skille ut proinflammatoriske cytokiner som IL-1, IL-6 og TNF, som aktiverer andre celler i immunsystemet. Gjennom dette bidrar de også til systemiske reaksjoner som feber og akutt-fase-respons, ved å virke som endogene pyrogener. Makrofager er altså ikke bare “spisere” – de er også viktige koordinatorer i kroppens immunologiske og inflammatoriske nettverk.
Eosinofile og basofile granulocytter
Blant kroppens granulocytter finner vi to relativt sjeldne, men funksjonelt svært viktige celletyper: eosinofile og basofile granulocytter.
De har begge store, tydelig fargede granula i cytoplasma, som er fylt med ulike bioaktive molekyler. Dette gjør dem sentrale i kroppens forsvar mot visse mikroorganismer, samt i immunologiske reaksjoner som allergi og hypersensitivitet.
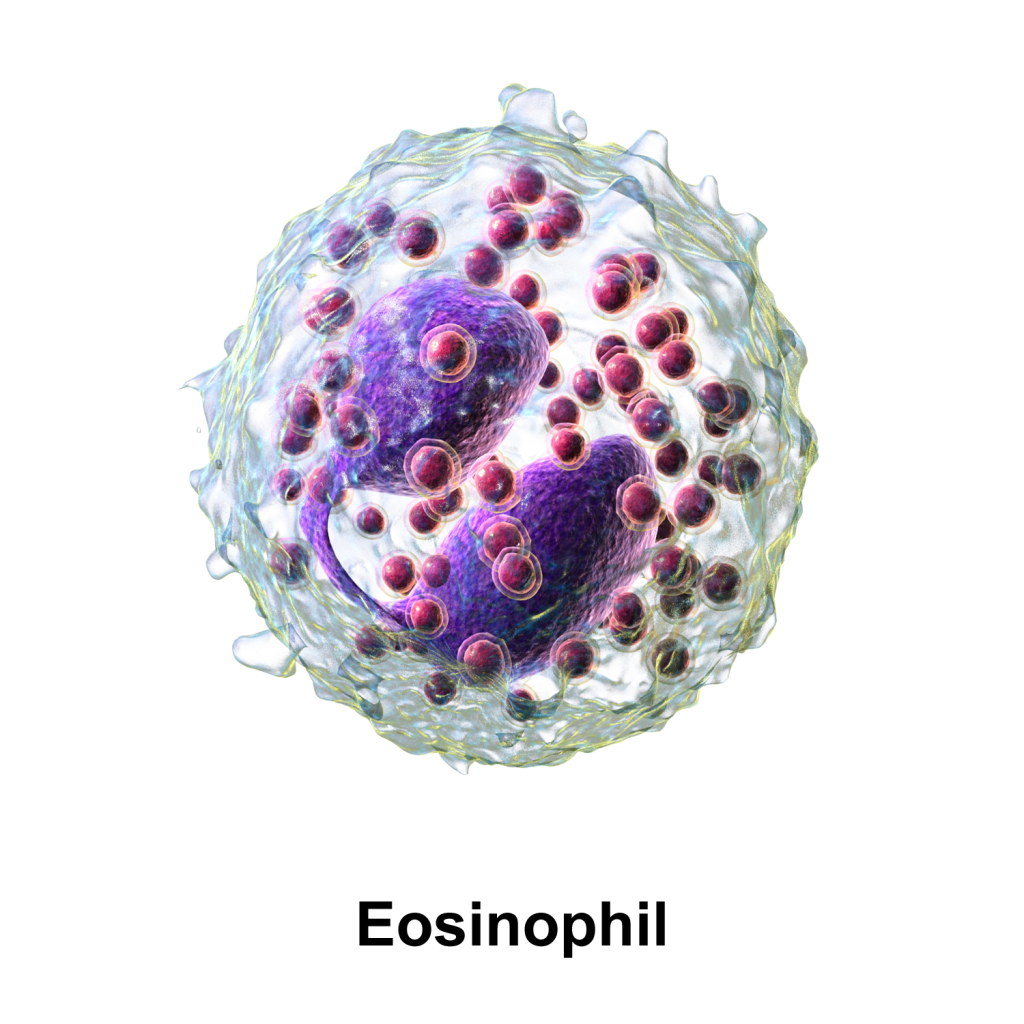
Eosinofile granulocytter kjennetegnes ved sine store, oransje-rosa granula som inneholder blant annet MBP (major basic protein) og histamin. Disse cellene er spesielt viktige i bekjempelsen av parasittinfeksjoner – deriblant flercellede parasitter som ormer – og spiller også en sentral rolle ved allergiske reaksjoner som astma. De responderer på kjemotaktiske signaler og ankommer infeksjons- eller inflammasjonsstedet, hvor de kan fagocytere, skille ut toksiske mediatorer og bidra til immunforsvaret gjennom både direkte angrep på patogener og regulering av andre immunceller.
Basofile granulocytter, derimot, er kroppens minst tallrike leukocytter og sirkulerer i blodet i under ett døgn. De har store, mørkeblå-lilla granula som inneholder histamin og heparin. Disse stoffene frigjøres ved aktivering og bidrar til vasodilatasjon, økt karpermeabilitet og antikoagulasjon. Basofile celler er nøkkelaktører i akutte hypersensitivitetsreaksjoner, som ved allergisk sjokk eller anafylaksi. Gjennom produksjon av interleukin-4 (IL-4) stimulerer de også B-lymfocytter til økt produksjon av IgE – et antistoff som videre forsterker allergiske reaksjoner.
Til sammen utgjør eosinofile og basofile granulocytter kroppens “spesialstyrker” for spesifikke typer trusler: parasitter og allergener. De samarbeider tett med andre deler av immunsystemet og har kraftige våpen i form av sine granula – som må reguleres nøye for å hindre skade på eget vev.
Lymfocytter – spesialstyrken i immunforsvaret
Lymfocytter utgjør omtrent 25–33 % av de hvite blodcellene i blodet, men de er mye mer enn bare et tall. De er en helt essensiell del av kroppens adaptive immunsystem – det vil si den delen av immunforsvaret som husker tidligere infeksjoner og tilpasser responsen etter hva kroppen har møtt før. I motsetning til det medfødte immunsystemet (som reagerer raskt og bredt), er det adaptive immunsystemet målrettet og spesialisert. Lymfocyttene finnes både i blodet og i lymfoid vev – som milten, lymfeknuter, tonsiller og Peyerske plakk i tarmen – og de sirkulerer kontinuerlig mellom disse områdene for å overvåke og forsvare kroppen.
Vi deler lymfocyttene i to hovedgrupper: T-lymfocytter og B-lymfocytter, i tillegg til en mindre gruppe kalt NK-celler (naturlige drepeceller). Vi fokuserer nå på T- og B-cellene.
T-lymfocytter – cellenes forsvarslinje
T-lymfocytter er sentrale aktører i forsvaret mot virusinfeksjoner og i regulering av immunresponsen. De er en del av det som kalles cellemediert immunitet, altså immunforsvar der celler (og ikke antistoffer) direkte angriper fiender eller koordinerer forsvaret.
T-cellene utvikles i beinmargen, men modnes og «utdannes» i thymus, der de lærer å skille kroppens egne celler fra fremmede. De gjenkjenner antigener via sin T-cellereseptor (TCR), som binder antigener presentert på overflaten av kroppens egne celler gjennom et system kalt MHC (major histocompatibility complex). Det finnes to typer MHC:
- MHC I finnes på alle kroppens celler og presenterer antigen for cytotoksiske T-celler.
- MHC II finnes bare på antigenpresenterende celler (som makrofager og dendrittiske celler) og aktiverer T-hjelperceller.
Vi har tre hovedtyper T-celler:
- Cytotoksiske T-celler (CD8+), som dreper virusinfiserte celler.
- T-hjelperceller (CD4+), som kommer i ulike varianter (TH1, TH2, TH17, TFH) og gir hjelp til andre immunceller.
- Regulatoriske T-celler, som demper immunrespons og forhindrer autoimmunitet.
Uten T-cellene ville ikke kroppen klart å organisere en effektiv og kontrollert immunrespons – de er som generalene i immunforsvarets hær.
B-lymfocytter – kroppens antistoffmaskiner
Der T-cellene håndterer celle-til-celle-kamp, er B-lymfocyttene spesialister i å lage antistoffer. De hører derfor til den humorale immuniteten, altså den delen av immunforsvaret som virker via løselige stoffer i blod og lymfe.
B-cellene gjenkjenner antigener direkte via B-cellereseptorer, som er membranbundne antistoffer. Når B-cellen binder et antigen, trenger den hjelp fra en T-hjelpercelle for å bli aktivert. Etter aktivering kan B-cellen utvikle seg til:
- Plasmaceller, som produserer store mengder spesifikke antistoffer.
- Hukommelses-B-celler, som ligger i dvale og kan aktiveres raskt ved ny eksponering for samme antigen.
B-celler gjennomgår også en prosess som kalles somatisk hypermutasjon, der genet for immunoglobulin muteres for å forbedre antigenbinding. Dette, kombinert med klonal seleksjon (bare de beste B-cellene får lov å vokse videre), gjør at immunforsvaret utvikler et nærmest uendelig arsenal av antistoffer med høy affinitet for spesifikke trusler.
📚 Anki-kort
Obs, tomt! Kommer etterhvert <3
📝 Eksamensoppgaver
👨⚕️ Klinisk case
Obs, tomt! Kommer etterhvert <3
❓ Test deg selv
Obs, tomt! Kommer etterhvert <3