Obstruktive lungesykdommer er en gruppe tilstander der luftstrømmen gjennom luftveiene er hemmet, først og fremst ved at det blir vanskeligere å tømme lungene under utpust. Dette skyldes enten økt motstand i luftveiene, svekket elastisk tilbakefjæring i lungevevet, eller en kombinasjon av begge deler. Fellesnevneren er en redusert luftstrøm under ekspirium, noe som kan påvises med spirometri.
Det karakteristiske ved obstruktive lungesykdommer er at pasienten ofte klarer å trekke pusten inn, men får problemer med å puste ut – særlig ved rask eller anstrengende pust. Dette gir symptomer som tungpust (dyspné), piping i brystet (wheezing), hoste og i mange tilfeller økt slimproduksjon. Sykdomsgruppen omfatter både reversible og irreversible tilstander, og behandlingen varierer etter diagnose og alvorlighetsgrad.
Diagnostisk bruker man forsert spirometri for å måle hvor mye og hvor raskt pasienten kan puste ut. Når forholdet mellom forsert ekspiratorisk volum på ett sekund (FEV₁) og forsert vitalkapasitet (FVC) er under 0,7 etter bronkodilatator, regnes dette som tegn på obstruktiv lungesykdom. Men hvilken sykdom som foreligger, og hvordan den skal behandles, krever videre vurdering.
Klassiske obstruktive sykdommer
Astma
Astma er en kronisk inflammatorisk luftveissykdom preget av varierende og ofte reversibel luftveisobstruksjon. Obstruksjonen skyldes økt reaktivitet i bronkiene, som fører til periodisk innsnevring av luftveiene, særlig i respons på triggere som allergener, kulde, anstrengelse eller infeksjoner. Astma kan ramme både barn og voksne, og har ofte en allergisk komponent.
KOLS (Kronisk obstruktiv lungesykdom)
KOLS er en irreversibel og progressiv obstruktiv lungesykdom som skyldes kronisk inflammasjon og strukturelle endringer i luftveiene. Hovedårsaken er røyking, og sykdommen rammer oftest personer over 40 år. KOLS deles gjerne i to hovedkomponenter: emfysem og kronisk bronkitt. Emfysem fører til tap av elastisk vev og destruksjon av alveolevegger, mens kronisk bronkitt gir økt slimproduksjon og kronisk hoste.
Bronkiektasier
Bronkiektasier er en kronisk tilstand med permanente utvidelser av bronkiene, ofte som følge av tidligere infeksjoner, medfødt sykdom (f.eks. cystisk fibrose) eller obstruksjon. De skadede bronkiene mister sin evne til å fjerne slim, noe som fører til kronisk hoste og hyppige infeksjoner. Ved fysisk undersøkelse kan man høre grove knatrelyder (raller), og ved CT kan man se de karakteristiske utvidede bronkiene. Luftveisobstruksjonen er ofte mindre uttalt enn ved astma eller KOLS, men kan være signifikant.
Spirometri og diagnostiske kriterier
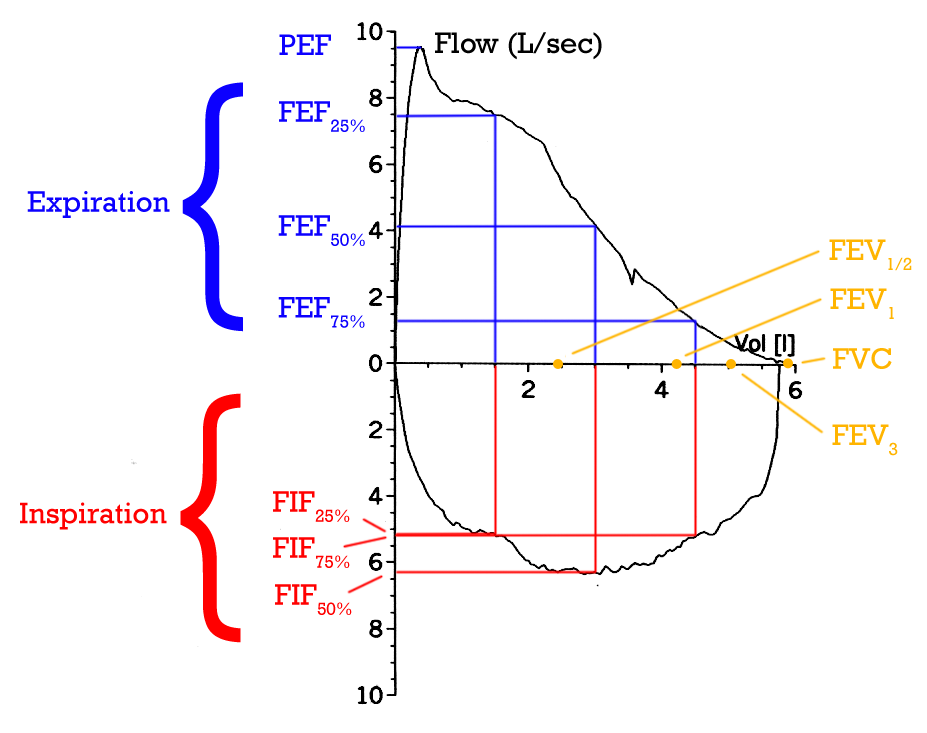
Spirometri er det viktigste verktøyet man har for å diagnostisere obstruktive lungesykdommer. Det er en enkel og objektiv undersøkelse som måler hvor mye og hvor raskt pasienten kan puste ut. Når luftveiene er trange, vil det ta lengre tid å få luften ut – og dette gjenspeiles i resultatene. Den mest sentrale verdien er FEV₁, altså hvor mange liter luft som pustes ut i løpet av det første sekunder av en kraftig utpust.
Sammen med FVC – forsert vitalkapasitet, som er den totale mengden luft som pustes ut i løpet av et maksimalt utpust – gir dette oss et forholdstall som sier noe om luftstrømmen: FEV₁ delt på FVC.
Hos friske voksne vil dette forholdet normalt ligge over 0,7.
Spirometri ved obstruktiv sykdom
Ved obstruktive sykdommer er det særlig FEV₁ som reduseres. Dette skjer fordi innsnevringen i luftveiene gjør det vanskeligere å få ut luften raskt, selv om totalvolumet (FVC) kan være nær normalt.
Resultatet blir at FEV₁/FVC synker. Derfor er et FEV₁/FVC-forhold under 0,7 det viktigste spirometriske kriteriet for å diagnostisere obstruktiv lungesykdom. Det er likevel viktig å tolke dette tallet i lys av alder, da både FEV₁ og FEV₁/FVC naturlig reduseres med alderen. Hos eldre kan man derfor få en falsk positiv tolkning dersom man kun bruker grenseverdien på 0,7. Noen retningslinjer anbefaler derfor å bruke den nedre normalgrensen (LLN) basert på referanseverdier, spesielt ved grensefunn.
For å skille mellom astma og KOLS er det avgjørende å undersøke om luftveisobstruksjonen er reversibel. Dette gjøres med en reversibilitetstest, der pasienten først utfører vanlig spirometri, og deretter får inhalere en rasktvirkende bronkodilator, som for eksempel salbutamol. Etter 10–15 minutter gjentas målingene. Dersom FEV₁ øker med minst 12 prosent og samtidig med minst 200 ml, regnes dette som en signifikant reversibel obstruksjon – og tyder sterkt på astma. Manglende reversibilitet etter bronkodilatator taler for KOLS, særlig hos en eldre pasient med lang røykehistorie.
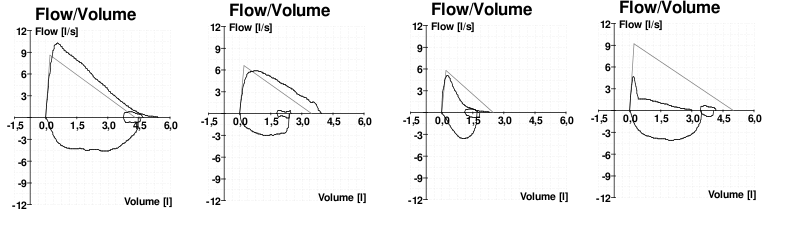
I tillegg til tallverdiene gir spirometrien også en visuell fremstilling i form av en flow-volume-kurve. Ved obstruktive sykdommer blir denne kurven karakteristisk: Den ekspiratoriske delen mister sin normale skrå form og får i stedet et avrundet og “hengekøyeaktig” utseende. Ved alvorlig obstruksjon kan den bli nesten flat, som et kirkespir. Disse formene gjør det lett å skille obstruksjon fra restriksjon, der kurven i stedet blir liten, men ellers formbevart.
I tillegg kan man måle variasjonen i PEF (peak expiratory flow) gjennom dagen, som er typisk stor ved astma og liten ved KOLS. Hos pasienter med mistenkt KOLS brukes ofte pletysmografi, også kalt body box, for å måle lungevolum og påvise tegn til luftfangst (air trapping). Man kan også måle diffusjonskapasiteten for karbonmonoksid (DLCO), som er redusert ved emfysem.
Astma
Astma er en kronisk betennelsessykdom i luftveiene som fører til periodisk og ofte reversibel luftveisobstruksjon. Det er en sykdom som rammer bronkiene, altså de nedre luftveiene, og som kjennetegnes av en overfølsomhet i luftveggene for ulike triggere som allergener, kulde, fysisk anstrengelse eller infeksjoner. Denne overreaksjonen – kalt bronkial hyperreaktivitet – fører til at luftveiene trekker seg sammen, slimproduksjonen øker, og pasienten får problemer med å puste ut. Astma forekommer i alle aldre, men starter ofte i barne- og ungdomsår, og har i mange tilfeller en allergisk komponent.
Patofysiologi
Kjernen i astma er en betennelse i bronkialslimhinnen som gjør luftveiene overfølsomme for stimuli som friske mennesker tåler godt. Dette skjer både ved allergisk og ikke-allergisk astma. I allergisk astma står såkalte Th2-celler sentralt. Disse T-hjelpecellene skiller ut cytokiner som IL-4, IL-5 og IL-13. IL-4 stimulerer B-celler til å produsere IgE-antistoffer, som binder seg til mastceller og gjør dem klare til å reagere ved neste kontakt med allergenet. Når mastcellene aktiveres, frigjør de histamin og andre mediatorer som gir akutt bronkokonstriksjon. IL-5 tiltrekker eosinofile granulocytter, som skiller ut toksiske proteiner som skader luftveisepitelet og forsterker inflammasjonen. IL-13 bidrar til økt slimproduksjon og endringer i epitelcellene.
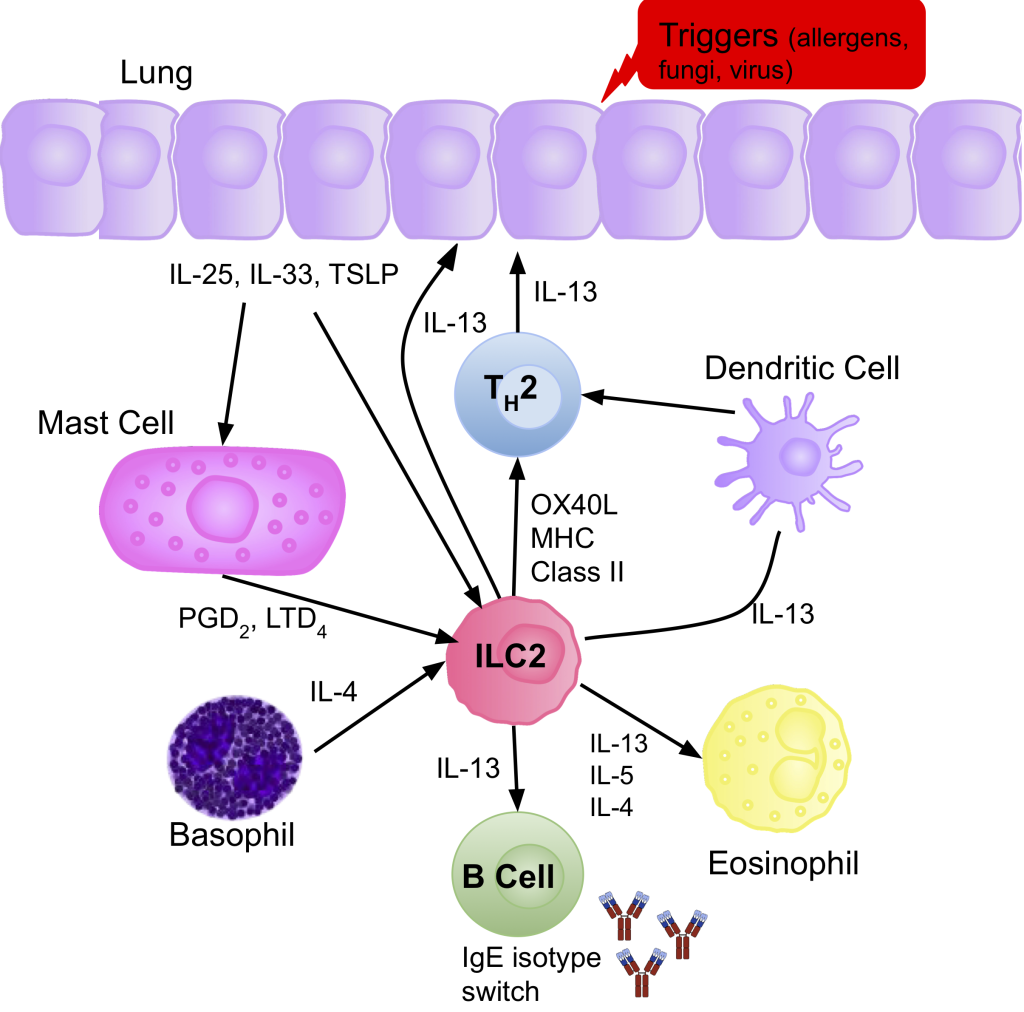
Ved ikke-allergisk astma aktiveres i stedet innate lymfoide celler (ILC2), som reagerer direkte på signaler fra skadet epitelvev og skiller ut de samme cytokinene – men uten IgE eller allergen-gjenkjenning. Dette forklarer hvorfor ikke-allergisk astma kan gi like alvorlige symptomer uten allergisk bakgrunn.
Felles for begge typene er økt antall slimproduserende gobletceller, fortykket basalmembran, økt mengde glatt muskulatur og trangere luftveier. Under et astmaanfall forsterkes dette ytterligere: Glatt muskulatur trekker seg sammen, slimhinnene hovner opp og produserer seigt slim, og lumen i bronkiene blir dramatisk innsnevret. Dette gjør det særlig vanskelig å puste ut, og luft fanges i lungene.
Kliniske symptomer og triggere
Astmapasienter opplever gjerne episoder med tung pust, tetthet i brystet, hoste og pipelyder ved utpust – kjent som “wheezing”. Disse episodene opptrer ofte om natten eller tidlig om morgenen og utløses gjerne av triggere som fysisk anstrengelse, kald luft, allergener eller luftveisinfeksjoner. Mellom episodene kan pasienten være helt symptomfri, særlig tidlig i sykdomsforløpet.
Noen pasienter har hoste som eneste symptom – såkalt “hostedominert astma” – og mange har forlenget utpust ved auskultasjon. Barn kan ha vansker med å beskrive tungpust og vise symptomer som rastløshet, hoste om natten eller redusert yteevne ved lek.
Diagnostikk
Diagnosen astma stilles på grunnlag av klinisk mistanke og objektiv testing. Spirometri er sentralt. Den viser ofte redusert FEV₁ og redusert FEV₁/FVC, men det som skiller astma fra KOLS, er at obstruksjonen vanligvis er reversibel. Etter inhalasjon av bronkodilator (f.eks. salbutamol) skal FEV₁ øke med minst 12 % og minst 200 ml – dette gir sterk støtte for diagnosen.
Hvis spirometrien er normal, men man fortsatt mistenker astma, kan man gjøre en bronkoprovokasjonstest, for eksempel med metakolin. En signifikant reduksjon i FEV₁ ved lav dose tyder på bronkiell hyperreaktivitet. Man kan også måle FeNO – et uttrykk for eosinofil inflammasjon – som ofte er forhøyet ved allergisk astma.
Ved mistanke om allergisk astma tas det gjerne blodprøver for total IgE og spesifikke allergier, samt eosinofile. Høye nivåer styrker diagnosen og kan også ha behandlingsmessige konsekvenser.
Behandling
Moderne astmabehandling handler både om å forebygge inflammasjon og lindre symptomer. Før 2019 ble akutte symptomer behandlet med korttidsvirkende beta-2-agonister (SABA) alene, som salbutamol. Men dette ga ikke kontroll på den underliggende betennelsen.
I dag anbefales det at selv pasienter med mild astma bruker inhalasjonssteroider (ICS), enten fast eller ved behov. Det såkalte SMART-regimet (Single Maintenance And Reliever Therapy) kombinerer langtidsvirkende beta-2-agonist (LABA) og ICS i én og samme inhalator – ofte formoterol + budesonid – og brukes både daglig og ved anfall.
Behandlingen trappes opp etter sykdommens alvorlighetsgrad:
- Ved mild astma kan ICS brukes ved behov.
- Ved moderat astma gis fast lavdose ICS, eventuelt kombinert med LABA.
- Ved alvorlig astma brukes høydose ICS + LABA, og eventuelt tillegg av LAMA (langtidsvirkende muskarinantagonist).
- Dersom dette ikke er nok, vurderes biologiske legemidler, som retter seg mot IgE, IL-5, IL-4/13 eller TSLP, avhengig av pasientens biomarkører.
Ved allergisk astma kan også allergen immunterapi (AIT) ha god effekt, særlig ved pollenallergi.
KOLS
Kronisk obstruktiv lungesykdom, eller KOLS, er en fellesbetegnelse på en gruppe tilstander som gir kronisk, progressiv og irreversibel luftveisobstruksjon. Sykdommen er nært knyttet til langvarig eksponering for skadelige partikler eller gasser, først og fremst tobakksrøyk. Over 85 % av KOLS-tilfeller skyldes røyking, men også yrkeseksponering, luftforurensning og genetiske faktorer som alfa-1-antitrypsinmangel kan spille en rolle. Tilstanden debuterer vanligvis etter fylte 40 år og utvikler seg gradvis, ofte uten at pasienten selv merker symptomene før sykdommen har blitt betydelig.
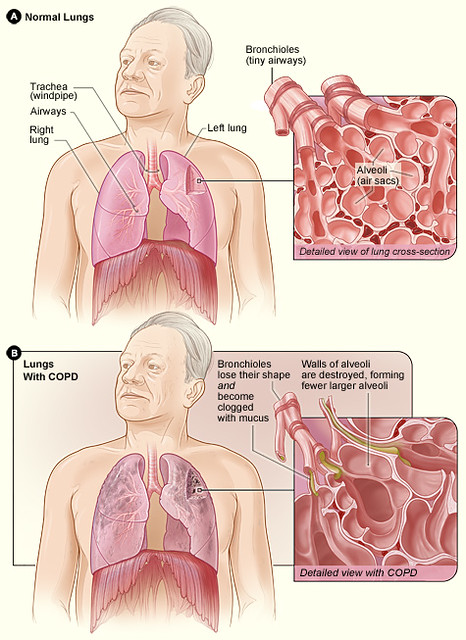
Patofysiologi
KOLS består av to hovedkomponenter som ofte forekommer sammen: emfysem og kronisk bronkitt. Ved emfysem ødelegges alveoleveggene, og de små alveolene smelter sammen til større, tynnveggede hulrom. Dette reduserer den samlede overflaten for gassutveksling og svekker lungens elastiske tilbakefjæring. Den tapte elastisiteten gjør det vanskelig for lungene å presse ut luften under ekspirasjon, og luft blir værende igjen i alveolene – et fenomen som kalles luftfangst eller air trapping. Over tid fører dette til at lungene blir permanent utspilt, og brystkassen får et tønnaktig preg.
Kronisk bronkitt, på sin side, innebærer en vedvarende betennelse i bronkiene som fører til økt slimproduksjon, hypertrofi av kjertler i slimhinnen, og fortykkelse av bronkialveggen. Resultatet er trangere luftveier og mer slim i lumen, noe som ytterligere hindrer luftstrømmen. Den vedvarende inflammasjonen fører etter hvert til strukturelle forandringer som fibrose og økt mengde glatt muskulatur i luftveiene, og dette bidrar til at obstruksjonen blir irreversibel.
De fleste KOLS-pasienter har innslag av begge disse mekanismene. Samlet fører de til en tilstand der det er vanskelig å puste ut, særlig ved anstrengelse. Luftveiene kollapser lett under ekspirasjon, og den ineffektive utluftingen fører til dynamisk hyperinflasjon – altså at mengden luft i lungene øker gradvis gjennom pustesyklusen, spesielt ved økt pustebehov. Dette øker ventilasjonsarbeidet og gir pasienten følelsen av tung pust (dyspné).
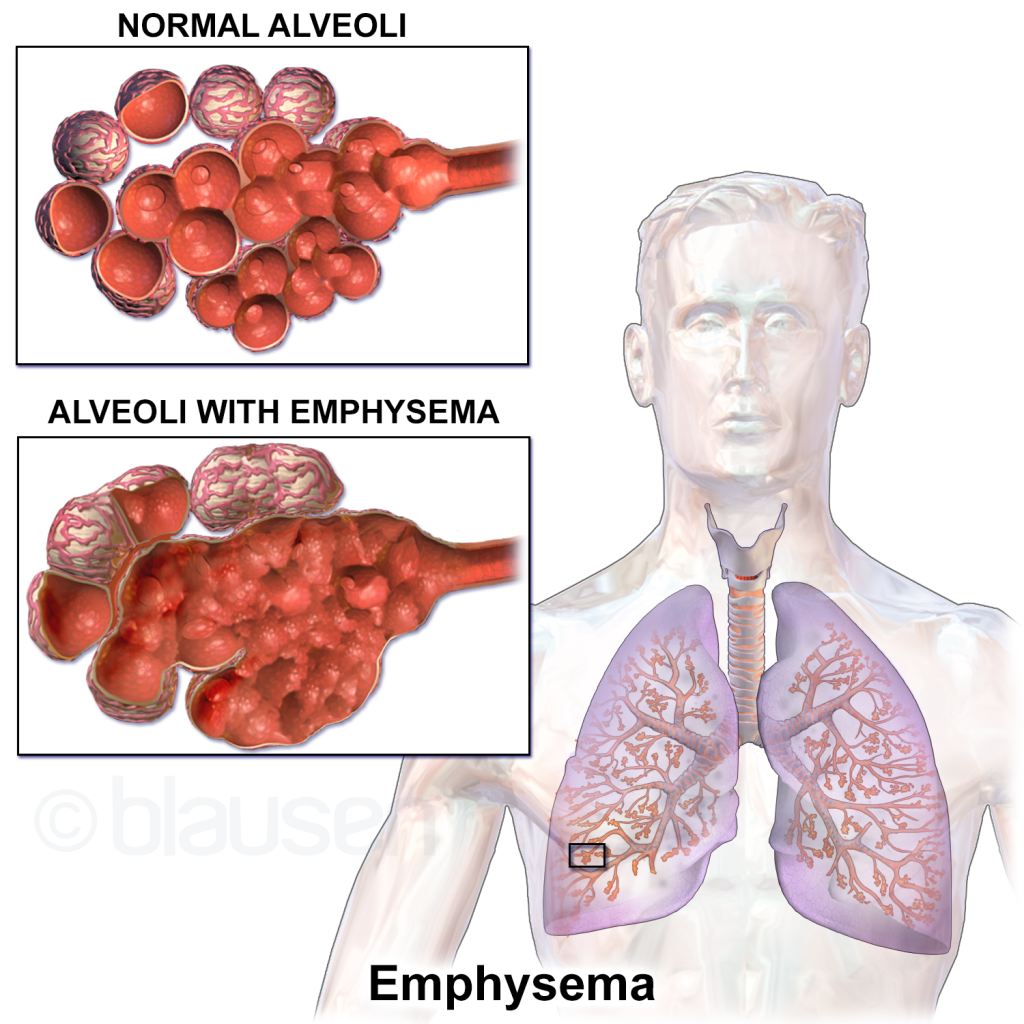
Kliniske trekk og fenotyper
Symptomene ved KOLS kommer snikende. Pasienten merker kanskje først at han blir tungpust ved bakker eller fysisk aktivitet, men tilskriver det gjerne alder eller dårlig kondisjon. Etter hvert kan dyspnéen bli tilstede også i hvile. Mange har også kronisk hoste, ofte med oppspytt av slim, særlig om morgenen. Dette skyldes den økte slimproduksjonen som følger med kronisk bronkitt. Pipelyder og forlenget ekspirasjon kan høres ved auskultasjon, og mange har nedsatte pustelyder.
To klassiske fenotyper av KOLS er tidligere blitt beskrevet: den “pink puffer” og den “blue bloater”. Førstnevnte har overveiende emfysem, med uttalt dyspné, tynn kroppsbygning og forlenget ekspirasjon, men relativt bevart oksygenering. Sistnevnte har overveiende kronisk bronkitt, med cyanose, produktiv hoste og hypoksi. I praksis har de fleste pasienter et blandingsbilde, men disse fenotypene kan være nyttige som pedagogiske modeller.
Diagnostikk
Diagnosen KOLS bekreftes ved spirometri som viser vedvarende luftveisobstruksjon, definert som FEV₁/FVC < 0,7 etter inhalasjon av bronkodilator. I motsetning til astma er obstruksjonen ikke reversibel. Alvorlighetsgraden vurderes ut fra hvor lav FEV₁ er i prosent av forventet verdi, samt pasientens symptomer og hyppighet av forverringer. Tilleggsverktøy som mMRC-dyspné-skalaen og CAT-scoren gir et bilde av pasientens funksjonsnivå og livskvalitet. CT og DLCO brukes ved behov for videre utredning, spesielt ved mistanke om emfysem.
Behandling
Det viktigste tiltaket er røykeslutt. Medikamentelt brukes langtidsvirkende bronkodilatatorer (LABA eller LAMA) som grunnbehandling. Ved mer uttalte symptomer eller eksaserbasjoner kombineres disse, og inhalasjonssteroider kan legges til. Ved alvorlig hypoksi vurderes langvarig oksygenbehandling. I tillegg anbefales influensa- og pneumokokkvaksine, lungefysioterapi og fysisk aktivitet.
Astma–KOLS-overlapp (ACO)
Astma–KOLS-overlapp, forkortet ACO, beskriver en tilstand der pasienten har symptomer og funn som forenes både med astma og med KOLS. I praksis betyr det at luftveisobstruksjonen er kronisk og ikke fullt reversibel, som ved KOLS, men at pasienten også har en historie preget av astma eller typiske trekk for astmatisk sykdom. ACO er ikke én spesifikk sykdom, men snarere et klinisk syndrom – en gråsone der grensene mellom astma og KOLS viskes ut.
Pasientene er ofte eldre og har røykt, men samtidig hatt astmaliknende symptomer tidlig i livet, eller fortsatt viser tydelig bronkial hyperreaktivitet. De kan ha signifikant reversibilitet i spirometri, men likevel vedvarende obstruksjon. De har ofte høyere eosinofilt nivå i blod og responderer bedre på inhalasjonssteroider enn det som er typisk for klassisk KOLS.
Det finnes ingen enhetlig definisjon, og det kan være utfordrende å skille ACO fra ren astma med irreversibel komponent, eller KOLS med eosinofil inflammasjon. Derfor krever ACO en individuell tilnærming der både symptomer, spirometri og biomarkører inngår i vurderingen.
Behandlingen tilpasses fenotypen: Pasienter med ACO har gjerne nytte av både bronkodilatatorer og inhalasjonssteroider, og mange trenger trippelbehandling (LABA + LAMA + ICS). Røykeslutt er like viktig som ved KOLS, og behandling av eventuelle allergier eller eosinofil inflammasjon må vurderes.
📚 Anki-kort
Obs, tomt! Kommer etterhvert <3
📝 Eksamensoppgaver
Obs, tomt! Kommer etterhvert <3
👨⚕️ Klinisk case
Obs, tomt! Kommer etterhvert <3
❓ Test deg selv
Obs, tomt! Kommer etterhvert <3