🎧 I farta? Lytt til en forklaring av temaet under!
Gjennom blodet leveres oksygen og næringsstoffer til cellene, avfallsstoffer transporteres bort, hormoner fraktes til sine målceller, og immunforsvaret patruljerer. Samtidig er blodet viktig for å opprettholde stabil temperatur, pH og væskebalanse i kroppen.
Blodet består av to hovedkomponenter: en væskedel, kalt plasma, og en celledel, som utgjøres av blodcellene.
Plasma er i hovedsak vann, men inneholder også elektrolytter, næringsstoffer, avfallsstoffer, gasser, hormoner og ulike proteiner.
Blant de viktigste plasmaproteinene finner vi albumin, som bidrar til å opprettholde det osmotiske trykket i blodbanen, immunglobuliner som inngår i immunforsvaret, samt koagulasjonsfaktorer og komplementproteiner som er avgjørende for blodets evne til å koagulere og bekjempe infeksjoner.
I tillegg finnes transportproteiner som transferrin (for jern), haptoglobin (for hemoglobin), lipoproteiner (for fettstoffer) og hormonbindende proteiner.
Den cellulære delen av blodet utgjøres av tre hovedtyper: røde blodceller (erytrocytter), hvite blodceller (leukocytter) og blodplater (trombocytter).
Alle disse produseres i benmargen.
Erytrocyttene har som hovedoppgave å frakte oksygen fra lungene til kroppens vev, ved hjelp av proteinet hemoglobin.
Leukocyttene er kroppens immunforsvar, og finnes i flere undertyper med spesifikke oppgaver i bekjempelse av bakterier, virus og andre trusler.
Trombocyttene er små cellefragmenter som deltar i blodets koagulasjonsprosess – de stanser blødninger og tetter igjen skadede blodårer.
Et voksent menneske har omtrent 5 liter blod, og omtrent 45 % av dette utgjøres av celler – dette kalles hematokrit.
De resterende 55 % er plasma.
Forholdet mellom celletypene er også verdt å merke seg: for hver hvite blodcelle finnes det omtrent 800 røde og 40 blodplater.
Til tross for at leukocyttene er færrest i antall, spiller de en kritisk rolle i immunsystemet, og er de største cellene i blodbanen. Erytrocyttene er noe mindre, og blodplatene er de aller minste.
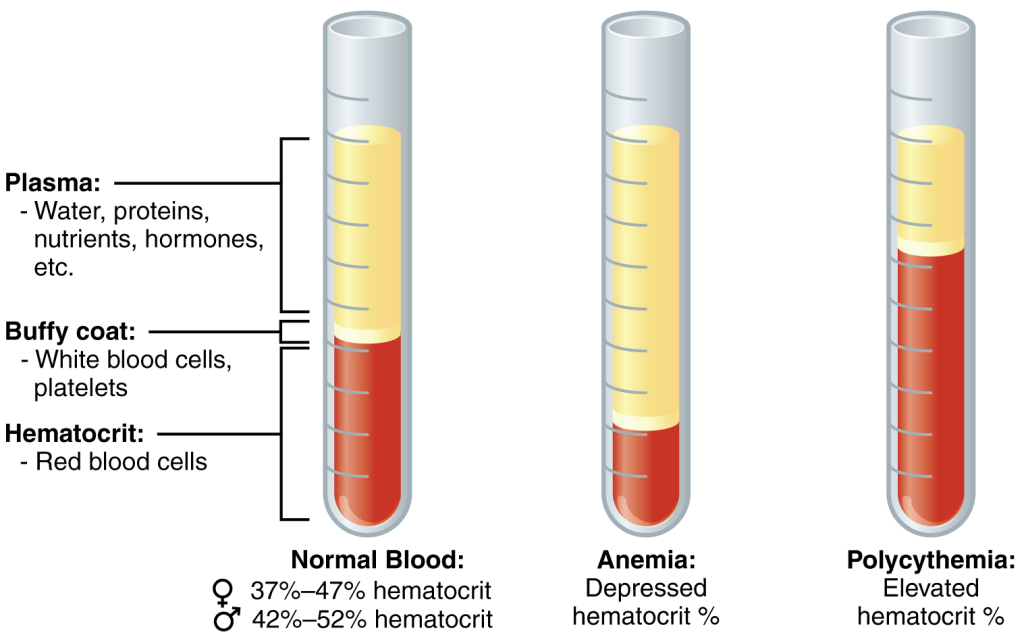
Når man sentrifugerer en blodprøve, kan man skille plasma og celler visuelt.
Hos en frisk person vil erytrocyttene legge seg i bunnen, med et tynt lag hvite blodceller og blodplater (det såkalte “buffy coat”) over, og plasma på toppen.
Hos pasienter med blodsykdommer, som for eksempel leukemi, kan dette bildet endre seg dramatisk.
En økt mengde umodne hvite blodceller kan gi et tykt, gråaktig lag og redusert andel normale erytrocytter – et funn som ofte er første tegn på sykdom.
Benmargen og det hematopoietiske miljøet
All blodcelleproduksjon hos voksne skjer i benmargen.
Det vi kaller rød benmarg er særlig aktiv hos voksne og finnes primært i flate knokler som bekkenet, brystbenet og ryggvirvlene.
I motsetning til gul benmarg, som hovedsakelig består av fett og er inaktiv i hematopoiese, er rød benmarg fylt med stamceller og deres datterceller i ulike utviklingstrinn.
Benmargen er en velorganisert struktur bestående av ulike komponenter som samarbeider tett for å sikre riktig celleproduksjon og modning.
Mikroskopisk ser man at benmargen ligger innenfor trabekulært ben – altså svampaktig benvev med tynne bjelker som danner hulrom hvor margvevet befinner seg. Disse hulrommene fylles av stroma, blodceller i ulike stadier og et rikt nettverk av små blodårer kalt sinusoider.
Stroma utgjør støttevevet i benmargen og består av fibroblaster, fettceller, makrofager, blodkar og en rekke andre celler som produserer vekstfaktorer og cytokiner.
Disse stoffene er avgjørende for at stamcellene skal overleve, dele seg og modnes riktig.
Stroma fungerer derfor som et slags mikromiljø som tilrettelegger for hematopoiese. Her får stamcellene signaler som forteller dem hva de skal bli, når de skal dele seg, og når de skal dø.
Sinusoidene i benmargen er spesielle blodkar med store åpninger i endotelet, som gjør at modne blodceller lett kan bevege seg ut i sirkulasjonen. Disse karene er en slags “utgangsport” hvor ferdigutviklede celler slipper gjennom og tas opp i blodbanen.
Hvis man ser på et histologisk snitt av benmarg, kan man observere et mylder av celler i ulike former og størrelser. Dette gjenspeiler at benmargen hele tiden produserer mange forskjellige celletyper – både røde og hvite blodceller, samt blodplater. Enkelte celler er store med tydelig nukleol og blålig cytoplasma – tegn på høy proteinsyntese og DNA-replikasjon, som sees i umodne celler. Andre er mindre, tettere og mer mørkfargede, ofte tegn på mer modne stadier.
I benmargen ligger altså produksjonslinjene for hele blodsystemet. Her begynner reisen for hver eneste erytrocytt, leukocytt og trombocytt.
Hematopoietisk stamcelle og differensiering
Alle blodceller dannes fra en felles forløper: den hematopoietiske stamcellen.
Dette er en multipotent celle med to sentrale egenskaper: den kan fornyes ved celledeling, og den kan differensiere til spesialiserte blodceller.
Denne doble funksjonen er grunnlaget for et balansert og fleksibelt blodsystem.
Stamcellene finnes hovedsakelig i benmargen, men finnes også i små mengder i perifert blod. Ved stamcelletransplantasjon utnyttes mobiliserte stamceller i blodet eller høstes direkte fra benmargen.
Evnen til å migrere fra blod til benmarg kalles homing, og styres av adhesjonsmolekyler på både stamcellen og endotelcellene i benmargens sinusoider.
Overflaten til hematopoietiske stamceller er preget av spesifikke markører, som gjør det mulig å identifisere og isolere dem.
De viktigste er CD34 og CD117 (c-kit), som uttrykkes i tidlige stadier.
Disse molekylene brukes klinisk for å identifisere umodne celler i diagnostikk og forskning, blant annet ved stamcelletransplantasjon.
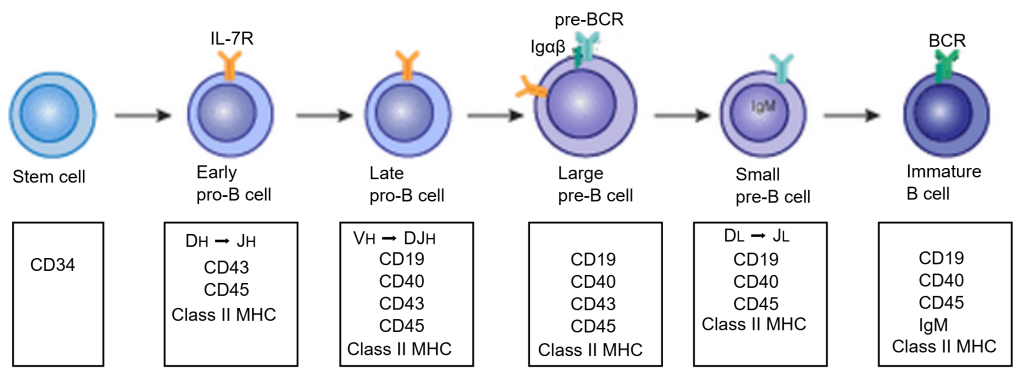
Stamcellene danner et hierarki av progenitorceller med stadig mer begrenset differensieringspotensial.
De første dattercellene kalles colony-forming units (CFU), og de har mistet evnen til selvfornyelse, men kan fortsatt gi opphav til én eller flere blodcellelinjer.
Etter hvert som differensieringen går videre, oppstår stadig mer spesialiserte celler som uttrykker linjespesifikke proteiner og får funksjonelle egenskaper, men samtidig mister evnen til å dele seg.
Det finnes to hovedretninger for differensiering: den myeloide linjen, som gir opphav til erytrocytter, granulocytter, monocytter og trombocytter; og den lymfoide linjen, som gir opphav til B- og T-lymfocytter.
Overgangen fra multipotent stamcelle til fullt moden, funksjonell celle er trinnvis, og reguleres nøye av en rekke vekstfaktorer, hormoner og interaksjoner med benmargens mikromiljø.
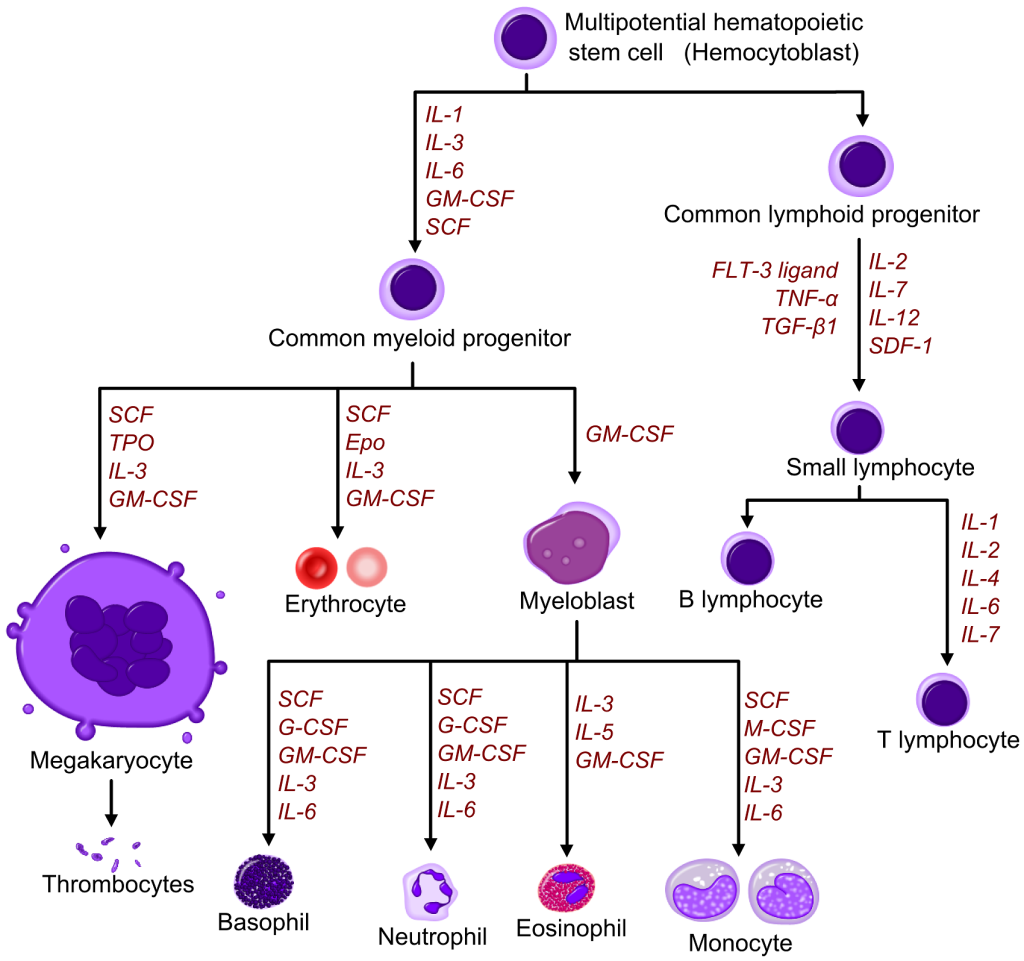
Differensiering er derfor en prosess som innebærer både tap og gevinst: stamcellene mister delingsevne og fleksibilitet, men oppnår spesifikke egenskaper som gjør dem i stand til å fungere i blodbanen eller i vev.
Dette gjør at systemet kan svare presist på kroppens behov for bestemte celletyper, enten det gjelder immunforsvar, oksygentransport eller hemostase.
Hematopoiese – dannelsen av blodets celler
Hematopoiese er betegnelsen på prosessen der alle blodets celler dannes fra hematopoietiske stamceller.
Denne prosessen foregår kontinuerlig i benmargen gjennom hele livet, og produksjonen er betydelig: hos et voksent menneske produseres det omtrent 10¹¹ blodceller per døgn, med høy grad av tilpasning til kroppens fysiologiske behov.
Systemet er organisert som et selvfornyende hierarki.
På toppen finner vi de multipotente stamcellene med evne til selvfornyelse og differensiering. Disse gir opphav til en rekke progenitorceller som gradvis mister selvfornyelsesevnen, men samtidig spesialiseres mot bestemte cellelinjer.
Etter hvert utvikles modne, funksjonelle blodceller klare for utslipp til sirkulasjonen.
Hematopoiesen er i kontinuerlig balanse mellom produksjon, modning og død. I tillegg til at cellene følger en utviklingsretning mot spesifikke funksjoner, skjer det også en streng kvalitetskontroll. Celler som ikke oppfyller nødvendige kriterier gjennomgår apoptose – programmert celledød – og fjernes av benmargsmakrofager.
En viktig egenskap ved hematopoiesen er dens evne til rask oppskalering ved behov. Ved infeksjoner, blødninger eller anemi kan benmargen kraftig øke produksjonen av de aktuelle celletypene, noe som krever både cellulære og humorale signaler.
Regulering av hematopoiese
Benmargen har stor reservekapasitet, og det er alltid et betydelig antall celler som er i dvale eller i tidlige utviklingsstadier. Ved behov kan denne kapasiteten raskt aktiveres. Aktivering skjer når kroppens signalstoffer når benmargen via blodbanen og binder seg til reseptorer på stamceller eller progenitorceller. Dette setter i gang celledeling, modning og differensiering mot spesifikke celletyper.
En rekke signalmolekyler regulerer hematopoiesen på ulike nivåer. Noen virker bredt på stamceller og tidlige forløpere, mens andre er mer spesifikke og påvirker bare én cellelinje. Her er noen sentrale grupper:
Tidlige og brede stimulatorer:
- SCF (stem cell factor) og FLT3-ligand: stimulerer deling og overlevelse av de mest primitive stamcellene.
Kolonistimulerende faktorer (CSF-er):
- G-CSF (granulocyte colony-stimulating factor): stimulerer modning av nøytrofile granulocytter.
- GM-CSF (granulocyte-macrophage CSF): virker på både granulocytter og monocytter.
- M-CSF: stimulerer utvikling av monocytter.
- IL-3 og IL-5: virker bredt, men har særlig betydning for eosinofile granulocytter.
Linjespesifikke hormoner:
- EPO (erytropoetin): regulerer dannelsen av røde blodceller.
- TPO (trombopoetin): regulerer utvikling av megakaryocytter og blodplater.
Synergistiske og modulerende cytokiner:
- Interleukiner som IL-1, IL-6, IL-7, IL-9, IL-11, IL-12 og LIF har komplekse roller og kan virke både direkte og indirekte, ved å forsterke effekten av andre signaler.
Hemmende og bifunksjonelle faktorer:
- Enkelte signalstoffer hemmer hematopoiese eller virker kontekstavhengig.
Disse inkluderer TNF-α, TGF-β, samt MIP-1α/β, IL-4, IL-8, og prostaglandiner som PGE1 og PGE2.
Cytokinene og vekstfaktorene produseres ikke bare i benmargen.
Mange dannes i andre organer (som lever, nyre og immunceller i perifert vev) og transporteres med blodet. I tillegg produserer stromacellene i benmargen selv mange av disse stoffene. Dermed fungerer benmargen både som et mottakende og produserende organ – et system med lokal tilpasning og overordnet koordinering.
Produksjonen av hver blodcellelinje styres av en nøye balanse mellom aktivering og hemming. For eksempel vil en infeksjon kunne øke nivåene av G-CSF, noe som akselererer produksjonen av nøytrofile granulocytter.
På samme måte vil lavt oksygennivå stimulere nyrene til å produsere EPO, som igjen øker erytropoiesen. Denne balansen kan også forstyrres ved sykdom, medikamentbruk eller ved genetiske defekter.
Erytropoiese – produksjon av røde blodceller
Erytropoiese er prosessen der røde blodceller – erytrocytter – produseres fra hematopoietiske stamceller i benmargen. Denne prosessen er avgjørende for kroppens evne til å transportere oksygen til vev, og reguleres nøye ut fra behov.
Hovedregulatoren av erytropoiese er hormonet erytropoetin (EPO).
Dette hormonet produseres i spesialiserte celler i nyrebarken, og produksjonen øker når oksygennivået i nyrene synker – enten som følge av anemi, blødning, høydeopphold eller lungesykdom.
Det hele styres av et oksygensensitivt transkripsjonsfaktor-system kalt HIF (hypoxia-inducible factor). Når oksygenet er lavt, stabiliseres HIF-1α og aktiverer EPO-genet, som fører til økt hormonutskillelse.
EPO reiser med blodbanen til benmargen og binder seg til reseptorer på erytroid progenitorceller.
Dette gir økt overlevelse og modning av celler i erytropoietisk linje. Uten EPO ville de fleste umodne erytroblaster gått til grunne via apoptose, og erytropoiesen ville stoppet opp.
Fra stamcelle til moden erytrocytt
Utviklingen av en moden rød blodcelle skjer gjennom flere definerte stadier. Fra stamcellen går utviklingen via:
- CFU-E (colony-forming unit-erythroid)
- Proerytroblast
- Basofil erytroblast
- Polykromatofil erytroblast
- Oksyfil erytroblast
- Retikulocytt (kjerneutstøtt, men fortsatt noe RNA)
- Moden erytrocytt
Denne modningsprosessen tar omtrent 7 dager. Når cellen er ferdig utviklet, mister den cellekjernen, og retikulocytten går over i sirkulasjonen.
I løpet av 1–2 dager fullføres modningen til en vanlig erytrocytt.
Erytrocytter har en levetid på rundt 120 dager i sirkulasjonen før de fjernes av makrofager i milt og lever.
Økt erytropoiese ved behov
Ved akutt behov for flere erytrocytter – for eksempel etter blødning – kan benmargen øke produksjonstakten betydelig. Dette skjer blant annet ved at transittiden reduseres: cellene modnes raskere, og flere retikulocytter slippes ut i blodet. Dette gir makrocytose og retikulocytose som typiske funn ved regenerativ anemi. Retikulocytter kan skilles fra modne erytrocytter ved spesialfarging og viser rester av ribosomalt RNA som gjør dem litt blåere og større i utstryk.
I motsetning til leukocytter og trombocytter er erytrocyttene ikke i stand til å dele seg etter utslipp i blodbanen. De har verken kjerne, mitokondrier eller evne til proteinsyntese. Det gjør dem svært spesialiserte til å frakte oksygen, men også fullstendig avhengige av kontinuerlig fornyelse fra benmargen.
Granulopoiese – produksjon av nøytrofile, eosinofile og basofile granulocytter
Granulopoiese er prosessen der granulocytter produseres og modnes i benmargen. Granulocytter utgjør en viktig del av det medfødte immunforsvaret, og inkluderer tre celletyper: nøytrofile, eosinofile og basofile. Alle dannes fra en felles myeloid stamcellelinje og modnes gjennom flere trinn før de slippes ut i blodbanen.
Modningstrinn og livssyklus
Utviklingen starter med den myeloide stamcellen, som differensierer til en myeloblast, og videre gjennom følgende stadier:
- Promyelocytt
- Myelocytt
- Metamyelocytt
- Stavkjernet granulocytt
- Segmentkjernet granulocytt (moden granulocytt)
Denne prosessen tar normalt 10–14 dager, men kan akselereres betydelig ved infeksjon. I et benmargsutstryk vil man kunne se alle disse stadiene, og mengden umodne celler gir informasjon om hvor aktiv granulopoiesen er.
Modne granulocytter har kort levetid i blodbanen – vanligvis 6–10 timer – før de vandrer ut i vev. I vevet overlever de i 1–2 døgn. Ved infeksjon øker produksjonen av granulocytter kraftig, både gjennom raskere modning og utslipp fra benmargens lagre.
Funksjonelle forskjeller mellom granulocyttene
- Nøytrofile er de vanligste og viktigste granulocyttene i bekjempelsen av bakterier. De fagocyterer mikrober og frigjør enzymer og reaktive oksygenforbindelser som dreper patogener.
- Eosinofile deltar i bekjempelse av parasitter og i allergiske reaksjoner. De inneholder granula med toksiske proteiner som frisettes ved aktivering.
- Basofile er sjeldne og lite forstått, men de spiller en rolle i allergiske og inflammatoriske prosesser. De inneholder histamin og andre mediatorer.
Alle tre celletype inneholder cytoplasmatiske granula med spesifikke proteiner og enzymer. Innholdet i granula varierer mellom celletypene og gir dem deres funksjonelle særpreg.
Regulering av granulopoiese
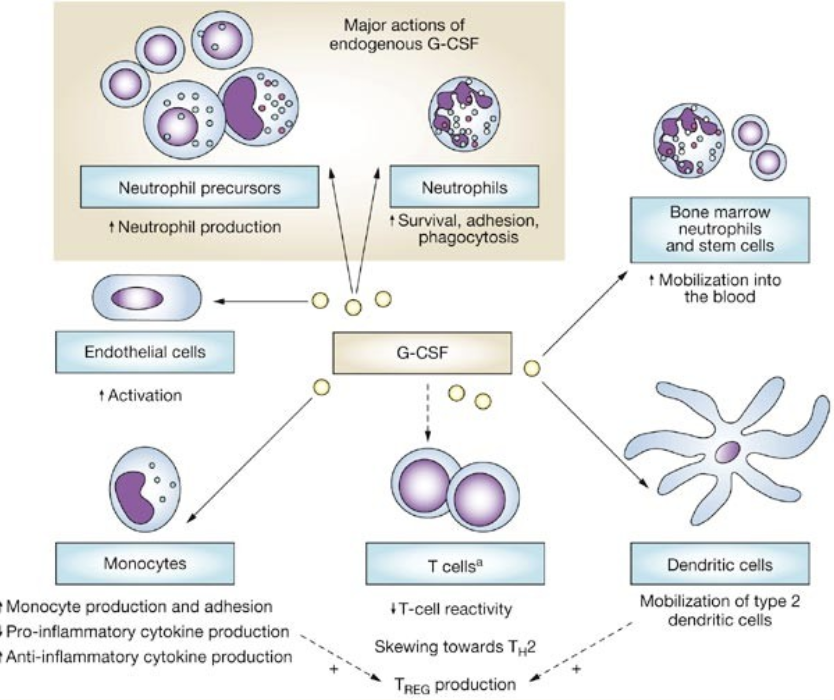
Produksjonen av granulocytter styres av flere cytokiner, hvor G-CSF (granulocyte colony-stimulating factor) er den viktigste. G-CSF stimulerer både proliferasjon og modning av nøytrofile, og brukes terapeutisk for å øke nøytrofile ved cytostatikaindusert nøytropeni.
Andre regulatoriske signaler inkluderer:
- SCF og IL-3: virker tidlig og bredt i den myeloide linjen
- GM-CSF: påvirker både nøytrofile og monocytter
- IL-5: spesifikk for eosinofile granulocytter
Ved infeksjon, inflammasjon eller stress mobiliseres reservelagre av modne granulocytter fra benmargen, samtidig som modningshastigheten øker. Dette skjer raskt og effektivt, og benmargen kan tredoble produksjonen av nøytrofile på få dager.
Trombopoiese – produksjon av blodplater
Trombopoiese er prosessen der blodplater (trombocytter) produseres fra store celler kalt megakaryocytter i benmargen.
Blodplater er cellefragmenter uten kjerne, og spiller en sentral rolle i blodets evne til å koagulere og stanse blødning. Til tross for at de er små og kortlivede, er de avgjørende for hemostase og finnes i stort antall i sirkulasjonen.
Fra stamcelle til blodplate
Trombopoiesen starter med hematopoietiske stamceller som gir opphav til megakaryoblasten, som modnes til en megakaryocytt – en av de største cellene i benmargen. I motsetning til andre cellelinjer, gjennomgår megakaryocyttene endomitose, en prosess der DNA replikeres uten celledeling. Resultatet er en celle med stor, multilobulert kjerne og et cytoplasma fullt av granula og strukturer som senere skal bli blodplater.
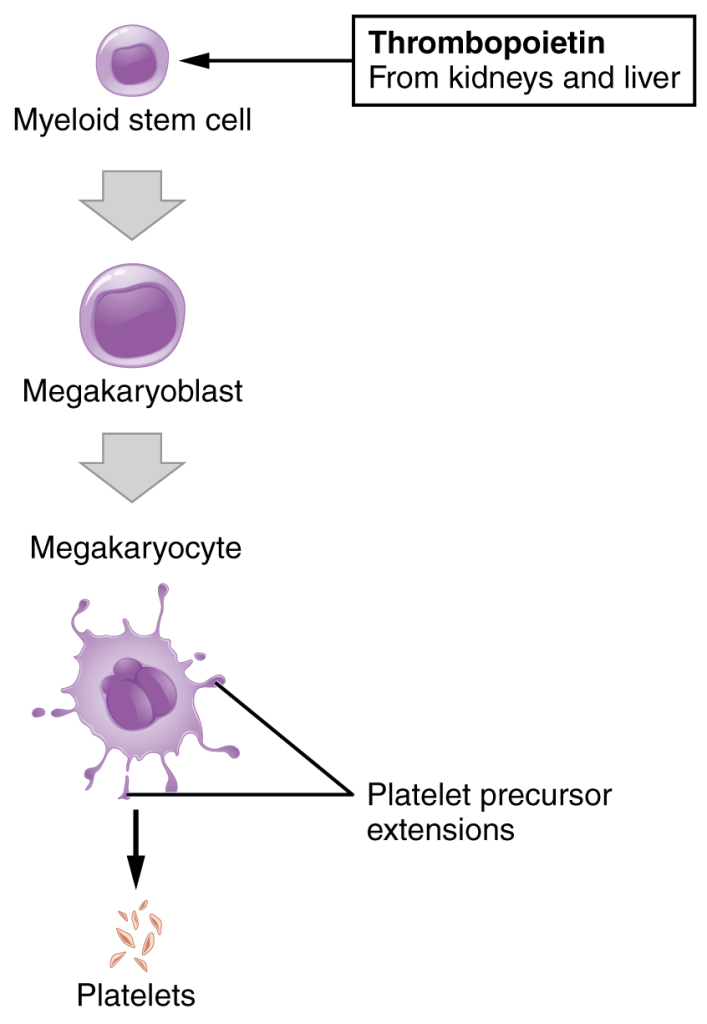
Modning og frisetting av blodplater
Modne megakaryocytter i benmargen utvikler lange utløpere av cytoplasma – kalt proplatelets – som strekker seg ut gjennom åpninger i det diskontinuerlige endotelet i sinusoidene. Der klyves cytoplasmaet gradvis opp, og mindre fragmenter løsner og føres med blodstrømmen som ferdige eller nesten ferdige trombocytter.
Flere av disse proplatene transporteres videre til lungenes mikrosirkulasjon, der det skjer ytterligere fragmentering og modning. Lungene fungerer dermed som et sekundært modningssted for trombocytter.
Hele prosessen fra megakaryocyttforløper (MKC-CFU) til frisetting av blodplater tar vanligvis 5–7 dager, og kan akselereres ved behov – særlig ved trombocytopeni eller inflammasjon.
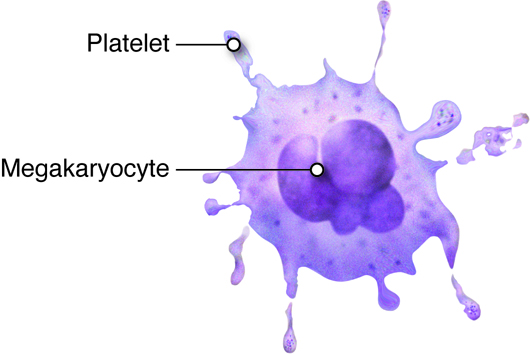
Regulering av trombopoiese
Hovedregulatoren for trombopoiese er hormonet trombopoetin (TPO). TPO produseres hovedsakelig i leveren, og regulerer både antallet og modningen av megakaryocytter. TPO-nivåene i blodet kontrolleres gjennom et negativt feedback-system: blodplater uttrykker reseptorer (c-Mpl) som binder og fjerner TPO fra sirkulasjonen. Når antallet blodplater er lavt, forsvinner mindre TPO – og nivåene i plasma øker, noe som stimulerer produksjonen av nye blodplater.
I tillegg til TPO kan interleukiner som IL-6 og IL-11 også stimulere trombopoiese, særlig ved inflammasjon. Dette er blant årsakene til at man ofte ser økt trombocyttall ved akutte infeksjoner.
Lymfopoiese – utvikling av B- og T-lymfocytter
Lymfopoiese er prosessen der lymfocytter dannes og modnes.
Lymfocytter tilhører den lymfoide cellelinjen og utgjør en viktig del av det adaptive immunforsvaret.
De finnes i tre hovedtyper: B-celler, T-celler og NK-celler (naturlige drepeceller). Både B- og T-celler stammer fra felles lymfoide progenitorceller i benmargen, men modningen deres skjer i ulike organer.
B-celler: utvikling i benmargen
B-lymfocytter utvikles og modnes fullstendig i benmargen. Underveis i utviklingen gjennomgår de en selektiv prosess hvor de rearrangerer gensegmenter for å danne sin unike B-cellereseptor (BCR).
Kun de cellene som klarer å uttrykke en funksjonell BCR, og som ikke reagerer på kroppens egne strukturer, får overleve og modnes videre.
Transkripsjonsfaktorene Pax5 og EBF-1 er spesielt viktige for B-celleutvikling og linjespesifikk differensiering.
Etter endt modning slippes B-cellene ut i blodbanen og migrerer til sekundære lymfoide organer som milt og lymfeknuter. Der kan de aktiveres ved kontakt med antigen, og noen utvikles videre til plasmaceller som produserer antistoffer.
T-celler: modning i thymus
T-lymfocytter modnes i thymus (brisselen), selv om de også dannes fra lymfoide progenitorceller i benmargen. De forlater benmargen i umodnet tilstand og reiser via blodbanen til thymus, hvor de undergår en streng seleksjonsprosess.
Under modningen utvikler T-cellene en T-cellereseptor (TCR) gjennom gensegmentrearrangering, og gjennomgår både positiv og negativ seleksjon:
- Positiv seleksjon sikrer at T-cellene kan gjenkjenne MHC-molekyler.
- Negativ seleksjon eliminerer T-celler som reagerer sterkt på kroppens egne proteiner.
Denne seleksjonen skjer i thymus’ kortikale og medullære områder og resulterer i immunologisk toleranse. Bare et fåtall T-celler overlever prosessen og slippes ut som modne, naive T-lymfocytter. Disse migrerer deretter til sekundære lymfoide organer, der de aktiveres ved kontakt med antigen.
Lymfeknuter og milt: møteplasser for aktivering
Etter at B- og T-cellene har forlatt benmargen og thymus, sirkulerer de i blod og lymfe og oppholder seg i lymfeknuter, milt og mukosale lymfoide vev. Her overvåker de kroppen for tegn på infeksjon. Ved aktivering gjennomgår de klonal ekspansjon og differensiering til effektorceller – som antistoffproduserende plasmaceller (B-celler) eller cytotoksiske og hjelperceller (T-celler).
Oppsummering og nøkkelpunkter
Hematopoiese er en kontinuerlig og livsnødvendig prosess som foregår i benmargen, der blodets celler produseres fra en felles stamcelle. Alle modne celler i blodet – røde blodceller, hvite blodceller og blodplater – har sitt utspring i den hematopoietiske stamcellen. Denne cellen kjennetegnes av evnen til både selvfornyelse og differensiering, og står øverst i et hierarkisk utviklingssystem.
Etter stamcellen følger en rekke progenitorceller og forløpere som gradvis mister potens og tilegner seg linjespesifikke funksjoner. Hematopoiesen deles i to hovedretninger: myelopoiese og lymfopoiese. Myelopoiesen omfatter dannelsen av erytrocytter, granulocytter, monocytter og trombocytter, mens lymfopoiesen gir opphav til B- og T-lymfocytter.
Reguleringen av hematopoiesen skjer gjennom et omfattende nettverk av cytokiner og vekstfaktorer. Noen virker bredt, mens andre er linjespesifikke:
- Erytropoiese styres i stor grad av EPO, produsert i nyrene ved lavt oksygen.
- Granulopoiese reguleres særlig av G-CSF, og øker raskt ved infeksjon.
- Trombopoiese styres av trombopoetin (TPO) fra leveren, og er knyttet til blodplatenes tilstedeværelse i sirkulasjonen.
- Lymfopoiese påvirkes av blant annet IL-7 og skjer i benmarg (B-celler) og thymus (T-celler), etterfulgt av modning og aktivering i sekundære lymfoide organer.
Benmargen er både et produksjonssted og en regulatorisk plattform, med strukturelle komponenter som stroma og sinusoider som legger til rette for vekst og utslipp av celler. Mikromiljøet, inkludert interaksjon med stromaceller, makrofager og endotel, er avgjørende for signalformidling og kvalitetskontroll.
Selv om hematopoiesen i utgangspunktet skjer i benmargen, kan det i enkelte tilfeller – som ved alvorlig benmargssvikt eller økt behov – oppstå ekstramedullær hematopoiese, der blodceller dannes i organer som lever og milt. Dette er vanlig i fosterlivet, men kan også reaktiveres patologisk hos voksne.
📚 Anki-kort
📥Klikk for å laste ned ankidekk på Blod og benmargens celler her.
📝 Eksamensoppgaver
👨⚕️ Klinisk case
Obs, tomt! Kommer etterhvert <3