Jern er et grunnstoff med helt avgjørende betydning for livet slik vi kjenner det. Det er et overgangsmetall som har den unike egenskapen at det lett kan veksle mellom to ulike oksidasjonstilstander – nemlig toverdig jern (Fe²⁺) og treverdig jern (Fe³⁺). Dette gjør jern spesielt godt egnet til å delta i redoksreaksjoner, altså reaksjoner der elektroner overføres fra ett molekyl til et annet. I biologiske systemer er slike redoksprosesser helt sentrale – blant annet i energiproduksjon, i transport av oksygen, og i mange enzymatiske reaksjoner.
Oksidasjon og reduksjon av jern
Når jern går fra Fe²⁺ til Fe³⁺, skjer det en oksidasjon – jernatomet avgir et elektron og blir mer positivt ladet:
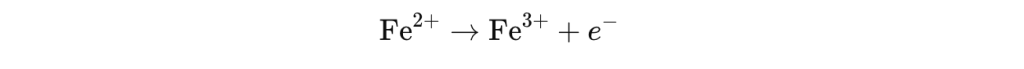
Motsatt, når jern går fra Fe³⁺ tilbake til Fe²⁺, skjer en reduksjon – jernet mottar et elektron:
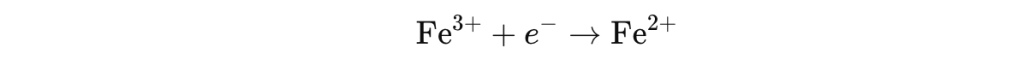
Denne fleksibiliteten mellom ladningstilstander gjør at jern kan fungere som elektronbærer i mange biokjemiske prosesser. Dette utnyttes av en rekke viktige proteiner i kroppen.
Nesten alle levende organismer – fra encellede bakterier til mennesker – er avhengige av jern. Hos mennesker brukes jern først og fremst til å transportere og lagre oksygen. Det skjer gjennom proteiner som hemoglobin og myoglobin, der jernet er bundet til en struktur kalt en hemgruppe. Hemgruppen gir ikke bare proteinet dets karakteristiske røde farge, men gjør det også i stand til å binde oksygen reversibelt – altså ta det opp i lungene og slippe det ut i vevene.
Men jerns rolle stopper ikke der. Jern er også essensielt i celleåndingen, hvor det inngår i mitokondrienes elektrontransportkjede. Her er det jernholdige proteiner som overfører elektroner fra næringsstoffer til oksygen, noe som til slutt fører til produksjon av ATP – cellens energivaluta.
I tillegg er jern viktig i DNA-syntese, i nedbrytning av puriner og som kofaktor for mange enzymer. Uten jern ville mange av kroppens viktigste prosesser stanset opp.
Jerns biologiske funksjoner
Jern er ikke bare et mineral kroppen trenger i små mengder – det er en uunnværlig komponent i noen av de mest kritiske biokjemiske prosessene i livet. Dette skjer hovedsakelig gjennom jernholdige proteiner, og vi skiller gjerne mellom to hovedgrupper: hemproteiner og jern-svovelklustere (Fe-S-klustere).
Hemproteiner – oksygentransport og mer
Hemproteiner er proteiner som inneholder en hemgruppe – en kompleks struktur som består av en porfyrinring med et sentralt jernatom. Dette jernet kan binde gasser som oksygen (O₂), karbondioksid (CO₂), karbonmonoksid (CO) og nitrogenoksid (NO). Hemgruppen er det som gir hemoglobinet i blodet sin røde farge, og det er den som muliggjør oksygentransport fra lungene og ut i kroppens vev.
Eksempler på hemproteiner:
- Hemoglobin – transporterer oksygen i blodet
- Myoglobin – lagrer oksygen i muskelceller
- Katalase – bryter ned hydrogenperoksid (H₂O₂) til vann og oksygen
- Cytokromer – overfører elektroner i mitokondrienes elektrontransportkjede
Jern-svovelproteiner – energi og enzymaktivitet
En annen viktig gruppe er jern-svovelproteiner, som inneholder Fe-S-klustere. Disse fungerer som elektronbærere i flere enzymer og spiller en avgjørende rolle i celleåndingen. Eksempler er:
- NADH dehydrogenase og suksinat dehydrogenase – begge er enzymer i elektrontransportkjeden
- Aconitase – et enzym i sitronsyresyklusen
- Xantinoksidase – deltar i purinmetabolismen
Disse jernholdige strukturene bidrar til at enzymene kan gjennomføre oksidasjons–reduksjonsreaksjoner og elektrontransport, noe som er helt nødvendig for at cellen skal kunne hente ut energi fra næringsstoffer.
Jern som kofaktor i enzymer
Jern fungerer også som en kofaktor – altså en ikke-proteindel som er nødvendig for at et enzym skal være aktivt. Det finnes en rekke enzymer der jern er en sentral del av det aktive setet. Eksempler inkluderer:
- 2-oksoglutarat dehydrogenase (viktig i sitronsyresyklusen)
- Tyrosinhydroksylase (i syntese av dopamin og andre katekolaminer)
- Ribonukleotidreduktase (viktig i DNA-syntese)
Sagt på en annen måte: Jern gjør det mulig for enzymer å fungere som små, presise kjemiske verktøy i cellen.
Jerns toksiske side
Selv om jern er livsnødvendig, kan det samme grunnlaget som gjør det nyttig også gjøre det farlig. Det er nemlig nettopp jernets evne til å delta i redoksreaksjoner – ved å veksle mellom toverdig (Fe²⁺) og treverdig (Fe³⁺) form – som gjør det potensielt toksisk. Når jern finnes i fri, ikke-proteinbundet form i kroppen, kan det reagere med oksygen og hydrogenperoksid og danne reaktive oksygenforbindelser, såkalte frie radikaler. Disse kan skade cellemembraner, proteiner, DNA og lipider, og i verste fall føre til celledød.
Det er særlig den toverdige formen av jern, Fe²⁺, som er reaktiv. I motsetning til den treverdige formen (Fe³⁺), som er relativt uløselig og stabil, er Fe²⁺ løselig og kan bevege seg fritt i væskefaser.
Denne formen deltar i Fenton-reaksjoner, der hydrogenperoksid (H₂O₂) omdannes til svært reaktive hydroksylradikaler (•OH). Hydroksylradikaler er blant de mest skadelige oksygenforbindelsene vi kjenner, og selv små mengder kan gjøre betydelig skade på cellestrukturer.
På grunn av denne toksiske potensialet har kroppen utviklet flere lag med sikkerhetsmekanismer.
Fritt jern finnes normalt sett ikke i plasma; det er alltid bundet til transportproteinet transferrin. Inne i cellene er jern bundet til ferritin, som fungerer som et slags jernlager. Disse proteinene sørger for at jernet holdes trygt utilgjengelig for uønskede reaksjoner. Når mengden fritt jern likevel blir for høy, som ved overopptak eller sykdom, kan skade oppstå.
Kronisk jernoverskudd gir ofte skade i organer med høy metabolsk aktivitet og stor blodforsyning. Leveren er særlig utsatt, og kan utvikle fibrose og etter hvert skrumplever. Hjertet kan rammes av jernindusert kardiomyopati, som gir nedsatt pumpefunksjon og hjertesvikt. Endokrine organer som bukspyttkjertelen og hypofysen er også følsomme for jernakkumulering, og dette kan føre til diabetes og hormonforstyrrelser som hypotyreose eller infertilitet.
Et eksempel på en sykdom som skyldes jernoverskudd er hemokromatose, en arvelig tilstand der jernopptaket fra tarmen er unormalt høyt. Over tid bygger det seg opp store mengder jern i kroppen, og dette kan gi alvorlig organskade hvis det ikke behandles. Omvendt kan jernmangel, som vi kommer tilbake til senere, føre til svikt i oksygentransporten og symptomer på anemi.
At jern både er livsviktig og potensielt livsfarlig, forklarer hvorfor kroppen har utviklet et så intrikat og tett regulert system for å holde jernnivåene i balanse.
Jernbalanse i kroppen
Balanse mellom tilførsel, lagring, transport og utskillelse av jern er avgjørende for å opprettholde normal kroppslig funksjon. Siden kroppen ikke har noen aktiv mekanisme for å kvitte seg med overskudd av jern, hviler ansvaret for jernbalansen nesten utelukkende på hvor mye jern som absorberes i tarmen. Denne balansen er derfor særlig sårbar – både for mangeltilstander og for opphopning.
Jernmangel oppstår når kroppens jerntilførsel ikke dekker behovet, eller når jern tapes i større grad enn normalt. Hos friske mennesker taper man svært små mengder jern daglig – om lag 1–2 mg – hovedsakelig via avføring, samt i mindre grad gjennom svette og urin. Kvinner i fertil alder mister betydelige mengder jern gjennom menstruasjonsblod, og dette er en av hovedårsakene til jernmangel hos kvinner. Andre vanlige årsaker til jernmangel er blødning fra mage-tarm-kanalen, som ofte kan være skjult og symptomfattig, samt økt behov ved graviditet og vekst.
På den andre siden av spekteret finner vi jernoverskudd. Når kroppen absorberer mer jern enn den trenger, og jernet ikke kan skilles effektivt ut, begynner det å hope seg opp i ulike organer. Det klassiske eksempelet på dette er hemokromatose – en genetisk tilstand der kroppens jernopptak er økt på grunn av feil i reguleringen av opptaket fra tarmen. Personer med denne tilstanden kan over tid utvikle alvorlige komplikasjoner som leverskade, hjertesvikt og endokrin svikt. Jern kan avleires i leveren og føre til skrumplever, i hjertet og forårsake redusert kontraktilitet, og i bukspyttkjertelen og gi diabetes mellitus.
Et velfungerende jernreguleringssystem sørger derfor for å tilpasse opptaket til kroppens behov. Dersom jerndepotene er lave, øker tarmens opptaksevne. Dersom jernlagrene er fulle, reduseres absorpsjonen. Denne justeringen skjer via flere mekanismer, men særlig sentral er det leverproduserte hormonet hepcidin, som hemmer transport av jern ut fra tarmcellene og makrofagene. Hepcidin fungerer som en slags bremsekloss for jernflyt inn i blodet, og denne bremsefunksjonen øker når jernlagrene er store – eller ved infeksjoner, der kroppen aktivt forsøker å sulte mikrober for jern.
Opptak og tap av jern
Kroppens jernnivå er i stor grad et resultat av balansen mellom hvor mye som tas opp i tarmen og hvor mye som tapes. I motsetning til mange andre mineraler og næringsstoffer, har kroppen ingen aktiv utskillelsesmekanisme for jern. Det betyr at kroppen i praksis ikke kvitter seg med jern med mindre det skjer via blodtap eller naturlig avgang av celler som inneholder jern – for eksempel i tarm, hud eller urinveier. Derfor er regulering av opptak fra tarmen den mest sentrale kontrollmekanismen for jernbalanse.
Naturlig jerntap
Hos friske personer tapes det svært små mengder jern hver dag – omtrent 1 til 2 mg – hovedsakelig via avføring. I tillegg skjer det små tap gjennom svette og urin. Dette daglige tapet kompenseres gjennom like stort opptak fra kosten, og det totale jerninnholdet i kroppen holdes slik relativt stabilt.
Noen situasjoner fører imidlertid til betydelig økt jerntap. Den mest vanlige er menstruasjon. Kvinner i fertil alder mister typisk 0,5 til 1 mg ekstra jern per dag som følge av månedlig blodtap. Ved fødsel kan jerntapet være betydelig større. Andre vanlige årsaker til økt jerntap er kronisk blodtap fra mage-tarm-kanalen, som kan skyldes alt fra magesår til tarmkreft eller betennelsestilstander. Selv små, men vedvarende blødninger kan over tid føre til jernmangel.
Jernbehov og kosthold
Det daglige jernbehovet varierer ut fra alder, kjønn og fysiologisk tilstand. For menn og ikke-menstruerende kvinner er behovet vanligvis omkring 10 mg per dag. Kvinner i fertil alder trenger mer – rundt 15 mg – og under graviditet kan behovet stige til 60 mg per dag mot slutten av svangerskapet, på grunn av økt blodvolum, fosterets behov og blodtap ved fødsel.
Et normalt norsk kosthold inneholder i gjennomsnitt 10 til 20 mg jern daglig. Men bare en liten andel av dette absorberes. Opptaket avhenger både av hvilken type jern som finnes i maten, og av kroppens behov.
Hem-jern og ikke-hem-jern
Jern i kosten finnes i to former: hem-jern og ikke-hem-jern.
Hem-jern finnes i animalske produkter som kjøtt, og tas lett opp – omtrent 30 % absorberes. Hem tas opp som en hel struktur inn i enterocyttene, der det brytes ned og frigjør jern. Ikke-hem-jern finnes i planter og melkeprodukter, og er mye vanskeligere å absorbere – vanligvis tas bare rundt 5–10 % opp.
I tillegg hemmes opptaket av ikke-hem-jern av ulike kostfaktorer. Fytater i grove kornprodukter, kalsium, tanniner i te og kaffe, samt høyt innhold av fosfat, kan redusere jernabsorpsjonen betydelig. På den andre siden kan C-vitamin fremme opptak ved å redusere treverdig jern (Fe³⁺) til toverdig jern (Fe²⁺), som lettere absorberes i tarmen.
Absorpsjon av jern i tarmen
Absorpsjon av jern skjer hovedsakelig i den øvre delen av tynntarmen, særlig i duodenum og øvre jejunum. Denne prosessen er nøye regulert og skjer gjennom ulike mekanismer avhengig av om jernet foreligger i form av hem-jern eller ikke-hem-jern. Absorpsjonen foregår via spesifikke transportproteiner i enterocyttene – de absorptive cellene som kler tarmoverflaten.
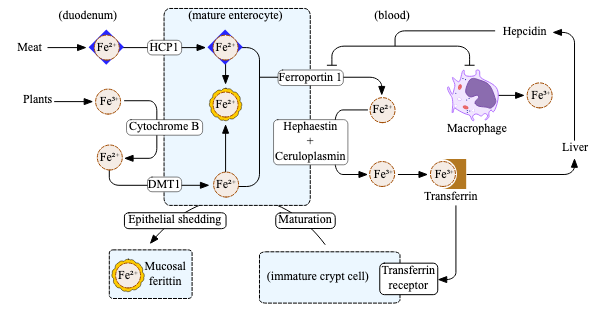
Hem-jern – lett absorberbar og effektiv
Heme jern absorberes direkte som en hel struktur gjennom cellemembranen til enterocyttene, via en spesialisert transportmekanisme som ennå ikke er fullt ut karakterisert. Tidligere har de tenkt at Heme Carrier Protein 1 (HCP1) var en heme transportør, men har funnet ut at den primært er en folattransportør. Så det er ingen konsensus i hva som transporterer heme inn, men poenget er at det transporteres som helhet.
Når hemet er kommet inn i enterocytten, brytes det ned av enzymet hem-oxygenase, som frigjør jernet. Dette jernet kan så enten lagres intracellulært eller fraktes videre ut i sirkulasjonen.
Ikke-hem-jern – avhengig av reduksjon og transportproteiner
Ikke-hem-jern finnes primært i treverdig form (Fe³⁺) i vegetabilske matvarer. Før det kan tas opp, må det først reduseres til toverdig jern (Fe²⁺), siden det kun er denne formen som kan transporteres over cellemembranen.
Reduksjonen skjer i tarmlumen, og er katalysert av enzymet duodenalt cytokrom B (Dcytb), som er lokalisert på enterocyttenes apikale membran.
Etter reduksjon transporteres Fe²⁺ inn i enterocytten gjennom en jernspesifikk kanal kalt Divalent Metal Transporter 1 (DMT1). Denne kanalen er svært viktig for ikke-hem-jernopptaket, og reguleres av kroppens jernbehov.
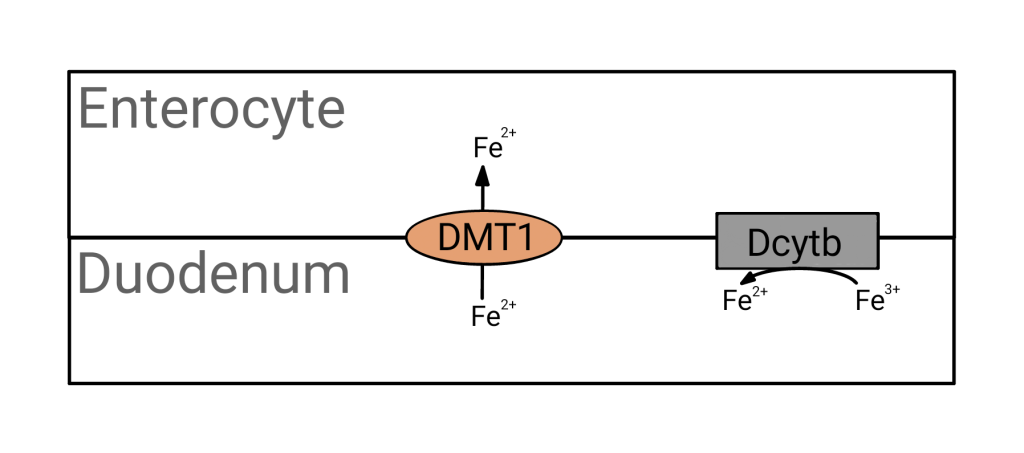
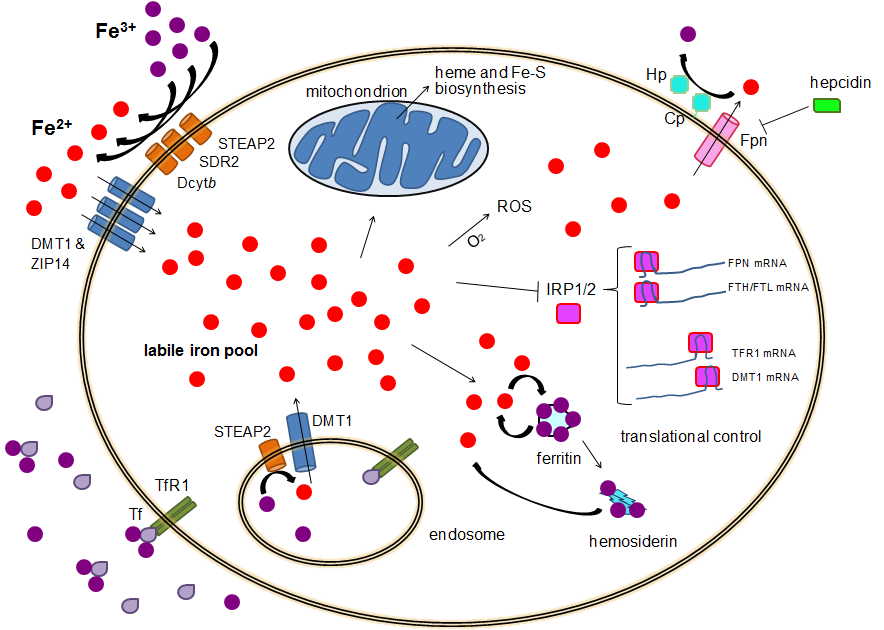
Inne i enterocytten – lagring eller eksport
Når jern er kommet inn i enterocytten, finnes det to mulige skjebner. Det kan enten lagres midlertidig som ferritin, eller det kan transporteres ut i blodbanen gjennom en annen kanal kalt ferroportin. Denne eksportkanalen finnes på den basolaterale siden av enterocytten – altså den som vender mot blodet.
Overgang til sirkulasjon – oksidasjon og binding til transferrin
Når jernet eksporteres ut gjennom ferroportin, skjer det fortsatt i toverdig form (Fe²⁺). Utenfor cellen oksideres det umiddelbart tilbake til treverdig jern (Fe³⁺), en prosess som katalyseres av enzymet hephaestin, som er nært beslektet med ceruloplasmin. Det oksiderte jernet binder seg deretter til transferrin, kroppens transportprotein for jern i plasma.
Transferrin kan binde to Fe³⁺-ioner per molekyl, og sirkulerer i blodet for å frakte jern til vev som trenger det – særlig benmargen for produksjon av nye erytrocytter.
Regulering av absorpsjonen
Hele denne absorpsjonsprosessen er nøye regulert av kroppens jernstatus. Når kroppens jerndepoter er lave, oppreguleres uttrykket av DMT1 og ferroportin, slik at mer jern tas opp og transporteres ut i blodbanen. Omvendt, når jernlagrene er fulle, nedreguleres disse kanalene, og absorpsjonen reduseres. Dette skjer blant annet under påvirkning av hormonet hepcidin, som vi kommer tilbake til senere.
Transport og lagring av jern
Når jernet er tatt opp i enterocyttene og eksportert ut gjennom ferroportin, må det fraktes til ulike deler av kroppen, lagres trygt og gjøres tilgjengelig for bruk. Kroppen har utviklet et effektivt system for å transportere og lagre jern uten at det opptrer i fri, toksisk form. Nøkkelaktørene i dette systemet er transferrin, transferrinreseptoren og ferritin.
Transferrin – kroppens jernbærer
Transferrin er et plasmaprotein med høy affinitet for treverdig jern (Fe³⁺). Ett transferrinmolekyl kan binde to jernioner. Når jernet først er bundet til transferrin i plasma, fraktes det trygt gjennom sirkulasjonen til celler som trenger det, særlig til benmargens erytroblaster, som skal produsere hemoglobin.
På overflaten av jernkrevende celler, særlig erytroblaster i benmargen, finnes spesifikke transferrinreseptorer (TfR). Transferrin med bundet jern (Fe³⁺) fra plasma binder til disse reseptorene, og hele komplekset tas inn i cellen via reseptor-mediert endocytose. Dette skjer altså ikke i enterocyttene, men i cellene som skal bruke jernet videre – for eksempel til syntese av hemoglobin.
Inne i det dannede endosomet synker pH til omkring 5,5, noe som fører til at jernet dissosierer fra transferrin. Jernet transporteres videre inn i cytoplasma og videre til mitokondriene for bruk i blant annet hemsyntese. Samtidig resirkuleres transferrinreseptoren og det nå jernfrie transferrinmolekylet (apotransferrin) tilbake til celleoverflaten. Ved normal pH (7,4) slipper apotransferrin taket og kan binde nytt jern i plasma.
Ferritin – jernlageret
Når jern er kommet inn i cellen, finnes det to hovedskjebner: enten skal det brukes, eller så skal det lagres. Lagret jern bindes til ferritin, et stort proteinskall som kan holde på opptil 4000 jernatomer i sin kjerne. Ferritin fungerer som en buffer for jern – tilgjengelig ved behov, men inaktivt og ufarlig så lenge det er lagret. Ferritin syntetiseres først som apoferritin (uten jern), og fylles så med jern etter hvert. Ferritin lagres i nesten alle celler, men spesielt i enterocytter, makrofager, hepatocytter og erytroblaster.
Siden ferritinmengden øker når kroppen har rikelig med jern, brukes serum-ferritin som en klinisk markør på jernstatus. Ved jernmangel er serum-ferritin lav, og ved jernoverskudd eller inflammasjon er den høy. Det er viktig å merke seg at ferritin også er et akuttfaseprotein, og nivået kan derfor stige ved infeksjon eller betennelse, selv om jernlageret egentlig er lavt.
Bruk av jern i cellen
Jern som ikke lagres, kan fraktes til mitokondriene, hvor det brukes i syntesen av hem og Fe-S-klustere. Hemsyntesen er en kompleks prosess som foregår både i cytoplasma og mitokondrier, og krever tilgjengelig jern for å fullføres. Uten nok intracellulært jern stopper denne prosessen, og cellen får ikke produsert hemholdige proteiner som hemoglobin, cytokromer eller katalase.
Transport, lagring og distribusjon av jern i kroppen er altså et tett regulert og elegant system, der toksisk fritt jern aldri får ferdes fritt. I stedet går det i trygg forvaring – fra transferrin i blodet, via TfR og endosomer, til lagring i ferritin eller bruk i livsviktige prosesser.
Hemsyntese og bruk av jern i cellen
Når jernet har kommet inn i cellen via transferrinreseptoren og frigjort seg fra transferrin i endosomet, har det i hovedsak to mulige skjebner: Det kan enten lagres som ferritin, eller det kan brukes direkte i biokjemiske prosesser – og den viktigste av disse er syntesen av hem. Denne prosessen foregår særlig i erytroblaster i benmargen, som har et høyt jernbehov for produksjon av hemoglobin.
Etter frigjøring fra endosomet fraktes jernet ut i cytosol, hvor det enten bindes til apoferritin for lagring, eller transporteres videre til mitokondriene. I mitokondriene inngår jernet i flere prosesser, men den mest kritiske er hem-biosyntesen. Hem er en kompleks struktur der jernet ligger sentralt i en porfyrinring, og dette molekylet brukes i hemoglobin, myoglobin, cytokromer, og flere andre viktige proteiner.
Hemsyntesen
Hemsyntesen foregår i både cytoplasma og mitokondrier, og krever presis tilgang på jern for at siste trinn i syntesen skal kunne fullføres. Jernet inkorporeres i porfyrinringen i mitokondriene i det siste syntesetrinnet, katalysert av enzymet ferrochelatase, som setter inn Fe²⁺ i protoporfyrin IX og danner funksjonelt hem. Uten tilstrekkelig jern, stopper denne prosessen opp, og hemkrevende proteiner kan ikke dannes.
Jernets funksjon i cellen
Etter inkorporering i hem brukes jernet i:
- Hemoglobin (i erytrocytter) – for oksygentransport
- Myoglobin (i muskler) – for oksygenlagring
- Cytokromer (i elektrontransportkjeden) – for ATP-produksjon
- Katalase og peroksidase – for avgiftning av reaktive oksygenarter
- NO-syntase og andre spesialiserte hemproteiner
I tillegg brukes jern i jern-svovelklustere (Fe-S) i mitokondrielle enzymer som NADH dehydrogenase og suksinat dehydrogenase, som er helt avgjørende for elektrontransport og energiproduksjon.
Regulering av jernmetabolismen
Reguleringen skjer på flere nivåer og inkluderer hormonell kontroll, intracellulær genregulering, og tilpasninger til oksygenbehov og inflammasjon. De tre viktigste reguleringspunktene er: absorpsjon fra tarmen, lagring i cellene, og frigjøring av jern til sirkulasjonen.
Intracellulær regulering: IRP og IRE
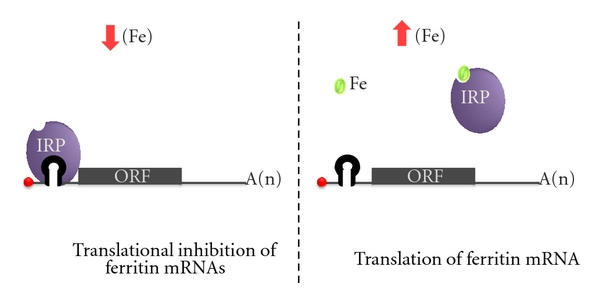
På cellenivå reguleres jernmetabolismen gjennom samspillet mellom iron regulatory proteins (IRP) og iron responsive elements (IRE). IRE er spesifikke sekvenser i mRNA som finnes i genene for ferritin og transferrinreseptoren (TfR). IRP kan binde seg til disse elementene og dermed regulere hvor mye ferritin og TfR som produseres.
- Ved jernmangel: IRP binder seg til IRE på ferritin-mRNA og blokkerer translasjonen, slik at det ikke produseres ferritin. Samtidig binder IRP seg til IRE på transferrinreseptor-mRNA, og stabiliserer det, slik at mer reseptor kan produseres. Resultatet er økt jernopptak og redusert lagring.
- Ved jernoverskudd: IRP binder i stedet jern og skifter konformasjon slik at det ikke lenger fester seg til IRE. Dette fører til at ferritin kan syntetiseres fritt (og lagre overskuddsjern), mens mRNA for TfR brytes ned. Resultatet er mindre jernopptak og mer lagring.
Dette gjør IRP/IRE-systemet til en elegant intracellulær «føler» for jernstatus, som justerer balansen mellom opptak og lagring lokalt i hver enkelt celle.
Hormonet hepcidin – kroppens jernbryter
På systemisk nivå reguleres jernmetabolismen av hepcidin, et lite peptidhormon produsert i leveren. Hepcidin fungerer som en negativ regulator av jernutslipp til sirkulasjonen. Det gjør dette ved å binde seg til ferroportin – det eneste kjente jerneksportproteinet i enterocytter, makrofager og hepatocytter. Når hepcidin binder ferroportin, fører det til at kanalen internaliseres og brytes ned. Resultatet er at jernet blir værende inne i cellen og ikke slippes ut i plasma.
- Ved høye jernlagre øker produksjonen av hepcidin, og uttransporten av jern reduseres.
- Ved jernmangel hemmes hepcidinproduksjonen, og mer jern slippes ut i sirkulasjonen.
Dermed fungerer hepcidin som en slags «hovedbryter» for jernflyten ut av tarm og makrofager, og tilpasser jernopptaket i forhold til kroppens totale behov.
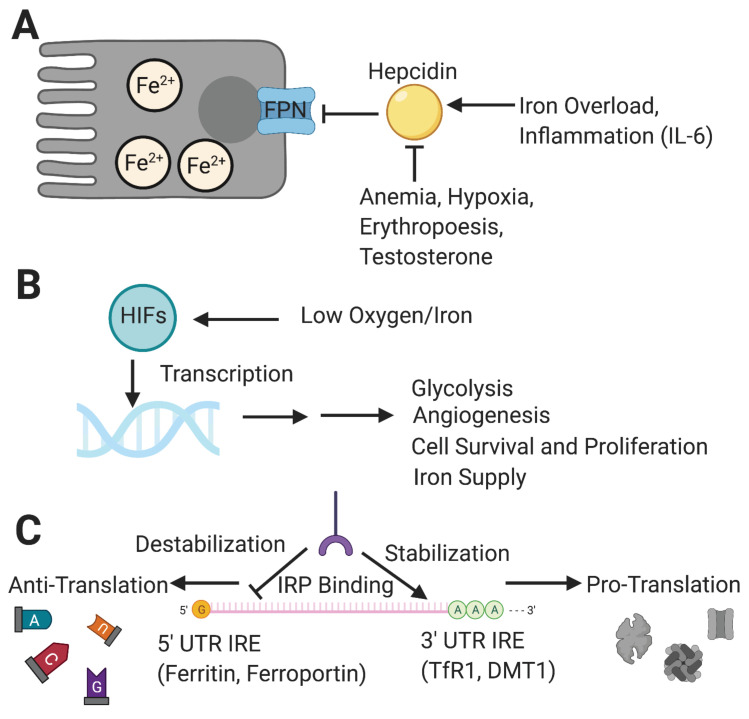
Påvirkningsfaktorer på hepcidinsyntesen
Produksjonen av hepcidin i leveren reguleres kontinuerlig i respons til kroppens jernstatus, oksygennivå, inflammatoriske signaler og hormonelle påvirkninger. Siden hepcidin kontrollerer hvor mye jern som frigis fra tarmen og makrofagene til sirkulasjonen, er denne reguleringen avgjørende for å sikre riktig jernbalanse.
Hepcidinsyntesen øker når kroppen har tilstrekkelige eller høye jernlagre – dette er en negativ feedback-mekanisme som bremser videre jernopptak.
Inflammasjon, særlig via cytokinet interleukin-6 (IL-6), stimulerer også hepcidinproduksjonen.
Dette er en del av kroppens immunforsvar: ved å holde jernet «innelåst» i cellene under infeksjon, fratar man bakterier og andre mikrober tilgang til dette essensielle næringsstoffet.
Hepcidinsyntesen reduseres i situasjoner der kroppen har økt behov for jern – for eksempel ved økt erytropoese eller høy produksjon av erytropoietin (EPO). Dette skjer naturlig ved blodtap, lav hemoglobinkonsentrasjon eller ved lavt oksygentrykk (hypoksi), hvor kroppen trenger mer jern til hemoglobinsyntese.
Et spesielt viktig, men ofte oversett hormon i denne sammenhengen, er østrogen. Østrogener har vist seg å hemme produksjonen av hepcidin, noe som i praksis fører til økt jernabsorpsjon fra tarmen. Dette bidrar til å forklare hvorfor kvinner i fertil alder – til tross for menstruasjonsblodtap – ofte klarer å opprettholde et visst jernopptak. Det forklarer også hvorfor overgangsalderen, med fall i østrogennivåer, kan medføre endringer i jernmetabolismen. Østrogenets hemmende effekt på hepcidin bidrar altså til en mer jernvennlig fysiologi hos kvinner i fruktbar alder.
Oppsummert:
- Øker hepcidin:
- Høye jernlagre
- Inflammasjon (særlig via IL-6)
- Reduserer hepcidin:
- Økt erytropoese (økt behov for hemoglobin)
- Økt EPO (erytropoietin)
- Hypoksi (lavt oksygennivå)
- Østrogener
Hypoksi og HIF-2α – koblingen mellom oksygen og jern
Ved lavt oksygeninnhold i vev aktiveres hypoksiinduserbare faktorer, særlig HIF-2α, som spiller en sentral rolle i tilpasning av jernmetabolismen til kroppens oksygenbehov.
HIF-2α aktiverer blant annet genene for DMT1, Dcytb og ferroportin i enterocyttene, og bidrar dermed til økt jernabsorpsjon. I tillegg virker hypoksi via økt EPO-produksjon og økt erytropoese, som indirekte senker hepcidinnivået og gir mer tilgjengelig jern til blodproduksjonen.
Jernstatus og kliniske mål
Jernstatus i kroppen har stor klinisk betydning, spesielt ved utredning av anemi, kroniske betennelsestilstander og jernoverbelastningstilstander som hemokromatose. I klinisk praksis finnes det flere blodprøver som gir innsikt i kroppens jernbalanse. De ulike analysene må tolkes i sammenheng, ettersom enkeltverdier ofte påvirkes av andre faktorer enn bare jernmangel eller jernoverskudd.
Serum-jern
Serum-jern måler mengden jern som er bundet til transferrin i plasma. Det er en svært variabel verdi, og påvirkes av både døgnvariasjon, matinntak og inflammasjon. Lavt serum-jern kan indikere jernmangel, men sees også ofte ved infeksjon og systemisk inflammasjon.
TIBC – total jernbindingskapasitet
TIBC står for Total Iron Binding Capacity, og gjenspeiler hvor mye transferrin som er tilgjengelig til å binde jern i plasma. Når jernlagrene er lave, øker leveren produksjonen av transferrin, og dermed stiger TIBC. Ved jernoverskudd eller inflammasjon kan TIBC være lavere.
Jernmetning (%)
Jernmetning beregnes som:
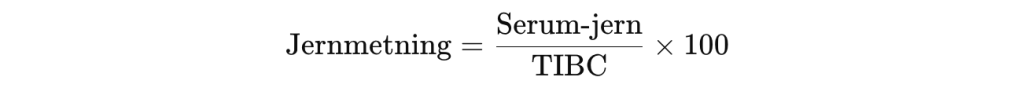
Den uttrykker hvor stor andel av transferrinets bindingsseter som er okkupert av jern. Ved jernmangel er metningen typisk under 15 %, mens ved jernoverbelastning (som ved hemokromatose) kan den være over 50 %.
Ferritin – kroppens jernlager i blodprøveform
Serum-ferritin er den viktigste markøren for kroppens jernlagre. Siden ferritin er et intracellulært lagerprotein som også lekker ut i sirkulasjonen i små mengder, kan man bruke S-ferritin som et indirekte mål på kroppens jernstatus. Lav S-ferritin er nesten alltid uttrykk for jernmangel, og en verdi under 15–30 µg/L gir sterk mistanke om tømte jerndepoter.
Viktig å huske: Ferritin er også et akuttfaseprotein – det vil si at det stiger ved inflammasjon, infeksjon, kreft eller kronisk sykdom, selv om jernlageret er lavt. I slike tilfeller kan en «falsk høy» ferritin skjule en reell jernmangel.
Jernstatus ved sykdom
Ved jernmangelanemi, som typisk oppstår ved kronisk blodtap, ser man en lav hemoglobinkonsentrasjon kombinert med lave verdier av både serum-jern og serum-ferritin. Kroppen forsøker å kompensere for mangelen ved å øke produksjonen av transferrin, og dermed stiger total jernbindingskapasitet (TIBC). Jernmetningen blir da lav, ofte under 15 %. I tillegg er det vanlig å finne små (mikrocytære) og bleke (hypokrome) erytrocytter ved mikroskopi av blodutstryk.
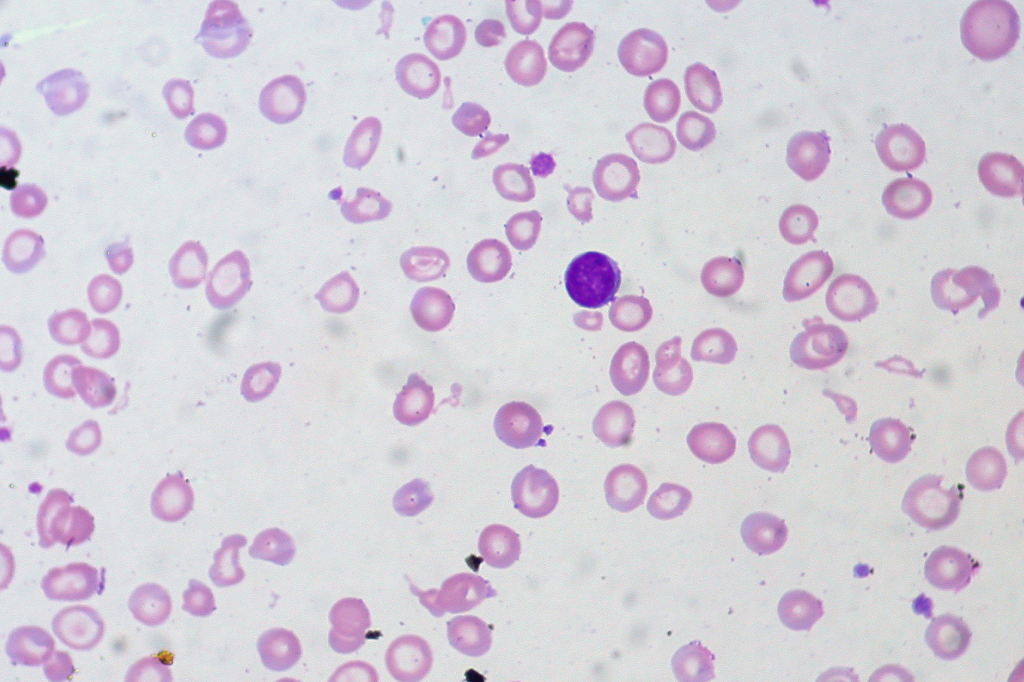
Ved anemi forbundet med kronisk sykdom – som ved infeksjon, inflammatoriske tilstander eller kreft – er jern tilgjengelig i kroppen, men utilgjengelig for bruk. Ferritinverdien er ofte normal eller forhøyet, både fordi lagrene er tilstede og fordi ferritin fungerer som et akuttfaseprotein. Serum-jern og jernmetning er likevel lave, og i motsetning til jernmangelanemi vil TIBC her typisk være lav, da leveren nedregulerer transferrinproduksjonen. Anemien er som regel normocytær, men kan også være lett mikrocytær.
Ved hemokromatose, en arvelig tilstand preget av kronisk jernoverskudd, ser man typisk forhøyet ferritin, økt serum-jern og høy jernmetning, ofte over 50 %. Hemoglobinnivået kan være normalt eller til og med høyt, spesielt i tidlige stadier. TIBC er ofte lav eller normal, siden kroppen ikke har behov for mer transferrin når jernet allerede er i overskudd.
Selv om laboratorieverdiene kan bekrefte at en pasient har jernmangel, er det helt avgjørende å forstå årsaken før man starter behandling. Jernmangel er ikke en diagnose i seg selv, men et symptom på en underliggende prosess – og det kan være alt fra forventet blodtap ved menstruasjon, til mer alvorlige årsaker som kroniske gastrointestinalblødninger eller malabsorpsjonstilstander.
Hos yngre kvinner er menstruasjon den vanligste forklaringen, men hos menn og postmenopausale kvinner må man alltid vurdere muligheten for okkulte blødninger fra mage–tarm-kanalen, som ved magesår, inflammatorisk tarmsykdom eller tarmkreft. Hos pasienter med lavt ferritin og anemi bør man derfor ikke nøye seg med å skrive ut jerntabletter, men i stedet spørre: Hvorfor mangler denne personen jern?
I noen tilfeller kan også absorpsjonsproblemer være årsaken, som ved cøliaki, etter ventrikkelreseksjon eller ved bruk av protonpumpehemmere. Hos eldre og hos pasienter med uspesifikke symptomer som tretthet og svimmelhet, kan jernmangel være første tegn på en underliggende sykdom.
Behandlingen bør derfor alltid tilpasses årsaken. Jerntilskudd uten utredning kan maskere symptomer, forsinke diagnoser og i verste fall føre til uheldig jernoverskudd hvis den egentlige årsaken ikke ligger i inntak, men i redusert omsetning eller tap.
📚 Anki-kort
Obs, tomt! Kommer etterhvert <3
📝 Eksamensoppgaver
Obs, tomt! Kommer etterhvert <3
👨⚕️ Klinisk case
Obs, tomt! Kommer etterhvert <3
❓ Test deg selv
Obs, tomt! Kommer etterhvert <3