Bioenergetikk – energi i levende systemer
Bioenergetikk er studiet av hvordan energi flyter i levende organismer. Det handler om hvordan celler produserer, lagrer og bruker energi, og hvordan denne energien driver alt fra muskelbevegelse til celledeling og proteinsyntese. I sentrum av dette står molekylet ATP (adenosintrifosfat) – cellens primære energivaluta.
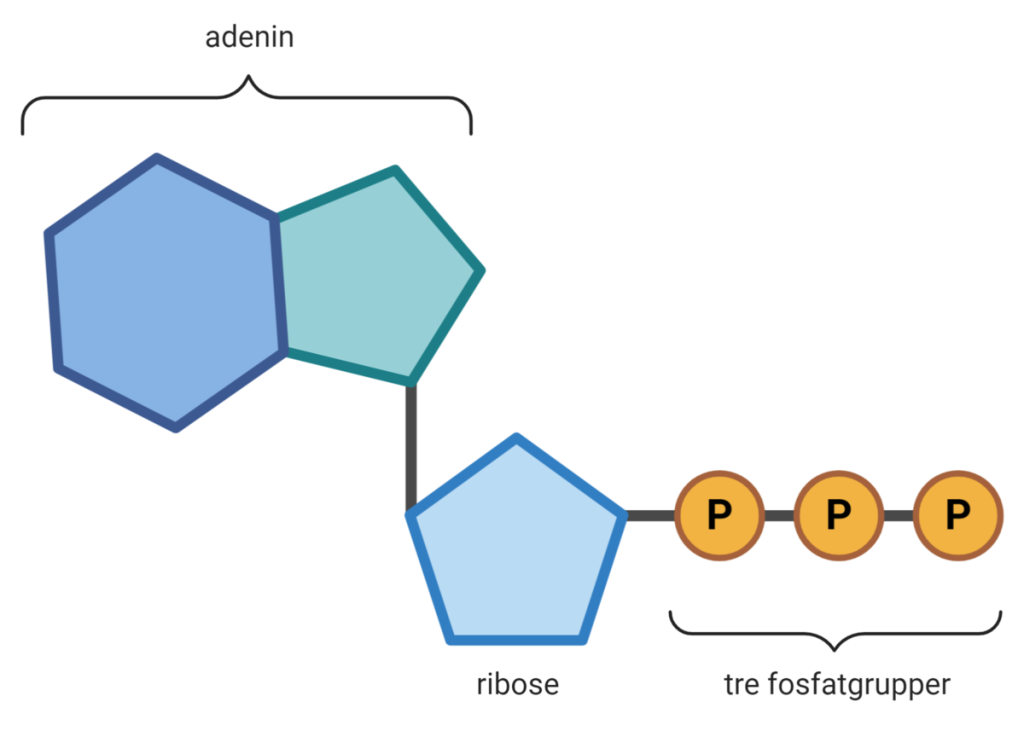
ATP
ATP består av tre deler: adenin (en nitrogenbase), ribose (et sukkermolekyl) og tre fosfatgrupper. Det er bindingene mellom disse fosfatgruppene som lagrer energi. Når cellen trenger energi, brytes den ytterste bindingen i ATP gjennom hydrolyse, og resultatet er ADP (adenosindifosfat) og én fri fosfatgruppe – og frigjort energi. Denne energien brukes direkte i cellulære prosesser, som muskelkontraksjon, aktiv transport og biosyntese. Hver celle produserer og resirkulerer millioner av ATP-molekyler hvert sekund for å holde kroppens maskineri i gang.
Celler får energien sin hovedsakelig fra næringsstoffer som glukose, fettsyrer og aminosyrer. Disse brytes ned gjennom glykolyse, sitronsyresyklusen (TCA-syklusen) og oksidativ fosforylering i mitokondriene. Sammen utgjør disse prosessene cellens energifabrikk, og sørger for at ATP produseres i takt med behovet. Når energibehovet øker, øker også produksjonen – og motsatt.
Termodynamikkens lover i biologiske systemer
Bioenergetikk bygger på fysikkens lover – spesielt termodynamikkens første og andre lov.
Den første loven slår fast at energi ikke kan skapes eller forsvinne, bare omdannes. I biologiske systemer betyr dette at energien som finnes i glukose eller fett ikke forsvinner – den overføres til ATP, som deretter brukes til å drive livsprosessene i cellene.
Den andre loven handler om entropi, altså graden av uorden i et system. Naturlige prosesser fører alltid til økt entropi – det vil si at systemer spontant blir mer uorganiserte. Celler arbeider kontinuerlig for å motvirke denne tendensen. For å opprettholde orden – bygge strukturer, reparere seg selv og kontrollere kjemiske reaksjoner – må cellene bruke energi. Liv er derfor ikke bare organisasjon, men energidrevet organisasjon.
Eksempel på økt entropi: Oksidasjon av glukose
Et godt eksempel på økt entropi i biologiske systemer er reaksjonen der glukose oksideres i cellene – altså den prosessen hvor kroppen henter energi fra maten vi spiser. Denne reaksjonen skjer gjennom flere trinn i glykolyse, TCA-syklus og oksidativ fosforylering, men det overordnede reaksjonsforløpet kan oppsummeres slik:
C₆H₁₂O₆ + 6 O₂ → 6 CO₂ + 6 H₂O + energi (ATP)
Vi starter med 7 molekyler: 1 glukose og 6 oksygenmolekyler. Resultatet er 12 molekyler: 6 karbondioksid og 6 vann. Dette innebærer at antallet partikler i systemet øker, noe som gir høyere grad av uorden, altså økt entropi.
Flere molekyler betyr at energien og partiklene blir mer spredt, og systemet får flere mulige måter å fordele energien på – som er selve definisjonen på økt entropi. Samtidig frigjøres varme og energi, som ytterligere bidrar til å spre energien til omgivelsene.
Selv om kroppen forsøker å opprettholde orden i cellene, skjer dette altså ved hjelp av prosesser som globalt sett øker entropien – helt i tråd med termodynamikkens lover.
Termodynamiske definisjoner – energi, varme og uorden
For å forstå hvordan energi flyter gjennom kroppen og hvordan cellene utfører arbeid, trenger vi noen sentrale begreper fra termodynamikken. Disse begrepene brukes til å beskrive hva som skjer med energi og orden i et system – enten det er en kjemisk reaksjon, en celle som forbruker ATP, eller varmeutveksling mellom kropp og omgivelser.
H – Entalpi
Entalpi (H) er et mål på den totale energien i et system ved konstant trykk. Den inkluderer både den indre energien systemet har lagret i bindinger og molekyler, og energien som kreves for å opprettholde volum og trykk.
Formelen for entalpi er:
H = U + PV
der U er indre energi, P er trykk, og V er volum.
Når vi snakker om hvordan entalpi endres under en reaksjon, bruker vi symbolet ΔH (delta H), som viser varmeutvekslingen:
- ΔH > 0: Reaksjonen er endoterm – den absorberer varme fra omgivelsene.
- ΔH < 0: Reaksjonen er eksoterm – den frigir varme til omgivelsene.
Formel:
ΔH = H_slutt – H_start
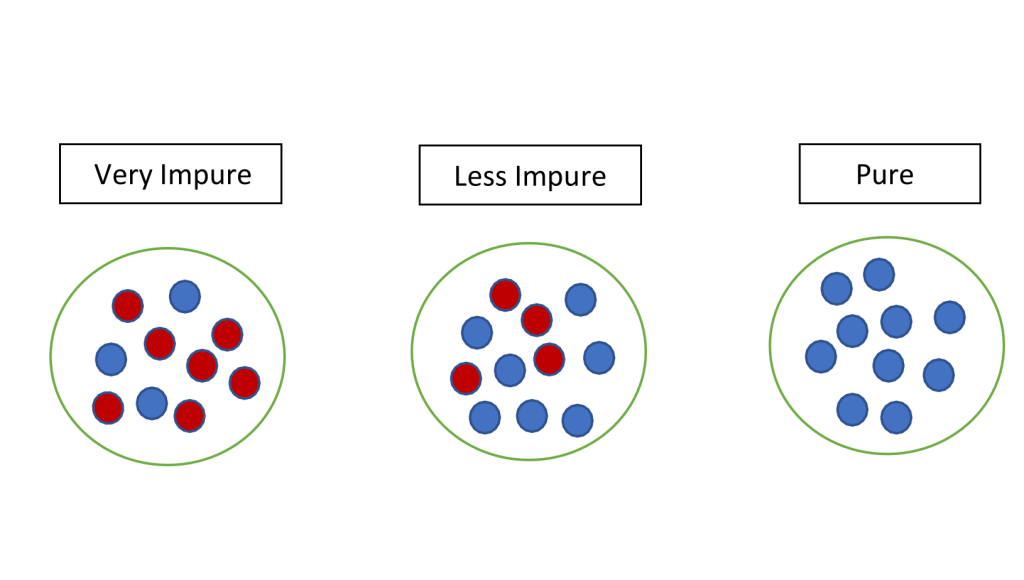
S – Entropi
Entropi (S) er et mål på uorden i et system – eller mer presist, antall måter energien i systemet kan fordeles på. Et system med høy entropi har mange mulige tilstander og er mer uorganisert, mens lav entropi betyr høy grad av orden.
Endring i entropi betegnes som ΔS, og viser om systemet blir mer eller mindre ordnet under en prosess:
- ΔS > 0: Systemet får mer uorden (økt entropi).
- ΔS < 0: Systemet blir mer ordnet (redusert entropi).
For eksempel: Når én glukosemolekyl spaltes til seks karbondioksidmolekyler og seks vannmolekyler, har antall molekyler og uorden økt – altså, entropien har økt.
G – Gibbs fri energi
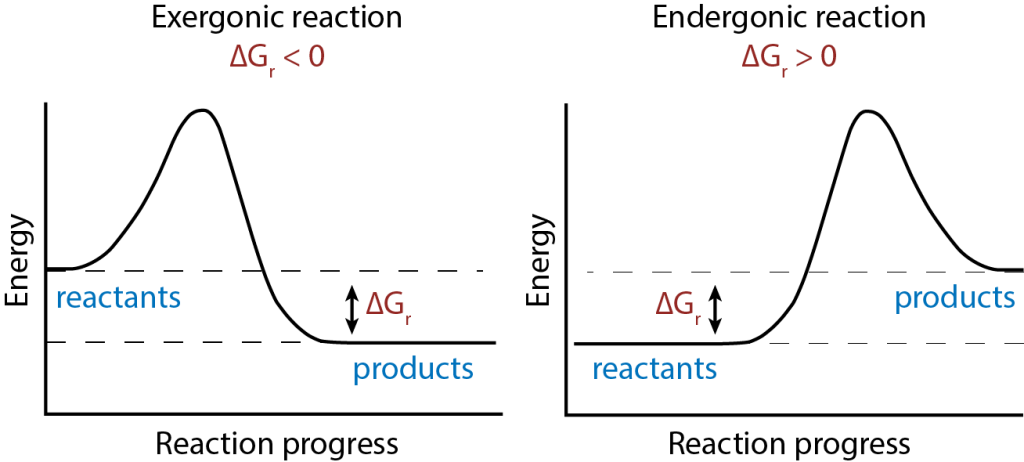
Gibbs fri energi (G) er et mål på hvor mye energi som er tilgjengelig til å gjøre nyttig arbeid i et system ved konstant temperatur og trykk. Det er kanskje det viktigste begrepet for å forstå om en kjemisk reaksjon kan skje spontant – det vil si uten at systemet må tilføres ekstra energi.
Endring i Gibbs fri energi skrives som ΔG:
- ΔG < 0: Reaksjonen er spontan – den kan skje av seg selv.
- ΔG > 0: Reaksjonen er ikke spontan – den krever energi utenfra.
- ΔG = 0: Systemet er i likevekt – det skjer ingen netto endring.
Disse størrelsene henger nøye sammen i den klassiske formelen for fri energi:
G = H – TS
eller for endringer i energi:
ΔG = ΔH – TΔS
Her er:
- ΔG = endring i Gibbs fri energi
- ΔH = endring i entalpi
- T = absolutt temperatur i Kelvin
- ΔS = endring i entropi
Formelen viser at fri energi påvirkes både av varmeendringer og graden av uorden i systemet. I biologiske systemer brukes den for å vurdere om for eksempel nedbrytning av glukose eller syntese av proteiner kan skje uten energitilførsel – og hvor mye ATP som kreves eller frigjøres i prosessen.
Energioverføring i levende organismer
Levende organismer er i stand til å opprettholde en høy grad av indre orden, til tross for at universets naturlige tendens er å gå mot økt uorden – altså økt entropi. Hvordan er dette mulig? Svaret ligger i organismenes evne til å oppta, omdanne og frigjøre energi, og i hvordan de balanserer indre orden mot ytre kaos.
Organismer henter fri energi (ΔG) fra omgivelsene, enten gjennom sollys (hos planter og fotosyntetiske bakterier) eller gjennom næringsstoffer (hos heterotrofe organismer som mennesker og dyr). Denne energien lagres opprinnelig i kjemiske bindinger i komplekse molekyler som glukose, fettsyrer og aminosyrer, og fungerer som en energikilde for cellenes livsprosesser.
Fra energiopptak til arbeid
Når cellen bryter ned disse molekylene, for eksempel i celleåndingen, frigjøres energi som brukes til en rekke biologiske funksjoner:
- Kjemisk arbeid, som syntese av DNA, RNA og proteiner
- Mekanisk arbeid, som muskelkontraksjon og bevegelse av organeller
- Transportarbeid, som opprettholdelse av ionekonsentrasjoner og membranpotensialer
- Osmotisk og elektrisk arbeid, som regulering av vannbalanse og signaloverføring
- Informasjonsarbeid, som replikasjon og lesing av genetisk kode
Alt dette krever energi i form av ATP, som igjen er produsert fra energiutvinning i cellens metabolisme.
Fra orden i systemet til uorden i omgivelsene
Selv om cellene bruker energi til å skape orden i seg selv, skjer det på bekostning av økt uorden i omgivelsene. En stor del av energien som frigjøres under metabolisme omdannes til varme, som sprer seg ut i omgivelsene og øker entropien (ΔS) der.
I tillegg brytes de komplekse næringsmolekylene ned til enklere stoffer, som karbondioksid (CO₂), vann (H₂O) og ammoniakk (NH₃), som skilles ut fra kroppen. Disse nedbrytningsproduktene er små, stabile og uorganiserte – og representerer en økning i entropi.
Balanse mellom system og omgivelser
Selv om organismen reduserer entropi internt ved å bygge opp strukturer som DNA og proteiner, øker den entropien i omgivelsene i enda større grad. Dette gjør at den totale entropien i universet likevel øker – akkurat som termodynamikkens andre lov krever:
ΔS_univers > 0
Levende systemer eksisterer derfor i en tilstand av konstant energiflyt. De bruker energi til å opprettholde orden, kjemisk kompleksitet og liv, samtidig som de betaler «prisen» for dette i form av økt uorden utenfor seg selv. Liv er med andre ord ikke et brudd på naturens lover – men et elegant samarbeid med dem.
Loven om massevirkning og fri energi i biologiske systemer
I levende celler skjer det tusenvis av kjemiske reaksjoner hvert sekund, og mange av disse er avhengige av forholdet mellom konsentrasjon, energi og likevekt. Et sentralt prinsipp som forklarer dette samspillet er loven om massevirkning, formulert av de norske forskerne Cato M. Guldberg og Peter Waage i 1864. Sammen med begreper som Gibbs fri energi og likevektskonstanter, gir dette oss verktøyene vi trenger for å forstå hvordan reaksjoner faktisk forløper inne i kroppen.
Loven om massevirkning
Denne loven sier at hastigheten på en kjemisk reaksjon er proporsjonal med konsentrasjonen av reaktantene. Vi kan skrive en generell reaksjon slik:
aA + bB ⇌ cC + dD
Her er A og B reaktantene, C og D produktene, og a, b, c og d er koeffisientene som viser hvor mange molekyler som inngår.
Reaksjonshastighet kan da uttrykkes som:
Rate = k[A]ᵃ[B]ᵇ
hvor k er en reaksjonsspesifikk konstant. Når reaksjonen når likevekt, stabiliseres konsentrasjonene slik at netto endring stopper, og forholdet mellom dem kan uttrykkes som en konstant:
K_eq = [C]ᶜ[D]ᵈ / [A]ᵃ[B]ᵇ
Denne likevektskonstanten (K_eq) er avgjørende for å forutsi hvilken retning reaksjonen foretrekker. Men for å virkelig forstå om en reaksjon skjer spontant, må vi se på fri energi.
Kobling av reaksjoner – hvordan cellen driver det umulige
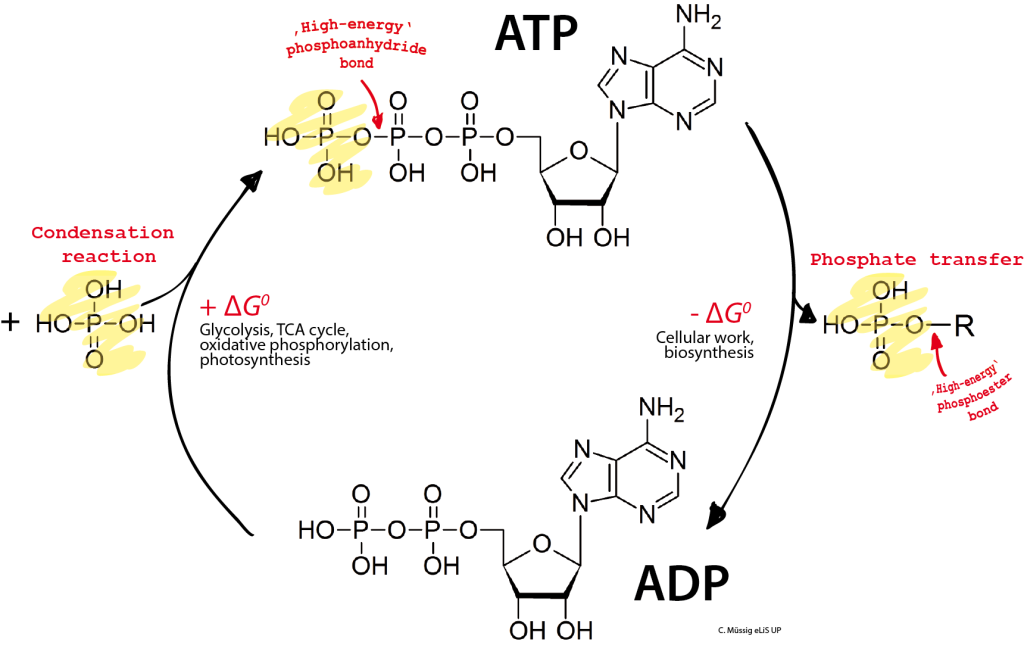
Mange biokjemiske reaksjoner er endergone (krever energi), men skjer likevel fordi de er koblet til eksoterme reaksjoner. Det mest kjente eksemplet er hydrolysen av ATP:
ATP + H₂O → ADP + Pi ΔG°’ = –30.5 kJ/mol
Denne reaksjonen frigjør mye energi og brukes til å drive mange energikrevende prosesser – som fosforylering av glukose i glykolysen.
Eksempel:
- Glukose + Pi → Glukose-6-fosfat ΔG°’ = +13.8 kJ/mol
- ATP + H₂O → ADP + Pi ΔG°’ = –30.5 kJ/mol
- Netto: Glukose + ATP → Glukose-6-fosfat + ADP ΔG°’ = –16.7 kJ/mol
Ved å kombinere reaksjonene, blir hele prosessen spontan, selv om den første reaksjonen alene ville vært ugunstig. Dette er et prinsipp cellen benytter hele tiden – å koble reaksjoner sammen slik at det totale ΔG blir negativt.
Additivitet av fri energi
En viktig egenskap ved ΔG° er at det er additivt. Det vil si at man kan summere fri energiendringer fra flere reaksjoner for å finne den totale energiforandringen. Dette brukes blant annet til å forutsi energiutbytte i metabolske veier, eller når man vurderer hvorvidt en kjemisk kobling vil fungere.
A → B ΔG°₁
B → C ΔG°₂
A → C ΔG° = ΔG°₁ + ΔG°₂
Hvorfor frigir ATP så mye energi?
ATP, eller adenosintrifosfat, er kjent som cellens «energivaluta». Når det hydrolyseres til ADP og uorganisk fosfat (Pi), frigjøres betydelig mengder fri energi – omtrent –30,5 kJ/mol under standard biokjemiske betingelser (ΔG°’). Men hvorfor er denne prosessen så energirik? Svaret ligger i molekylær stabilitet og fysikalsk kjemi, og kan forklares med fire hovedårsaker:
1. Redusert ladningsfrastøtning
ATP inneholder tre fosfatgrupper, og hver av dem bærer negative ladninger ved fysiologisk pH. Disse ladningene ligger tett inntil hverandre og skaper elektrostatisk frastøtning, noe som gjør ATP ustabil. Når ATP spaltes, og én fosfatgruppe (Pi) fjernes, reduseres denne ladningsspenningen.
Resultatet er et mer stabilt molekyl – og fordi systemet går fra en ustabil tilstand til en mer stabil en, frigjøres energi.
2. Resonansstabilisering av fosfatgruppen (Pi)
Den frie fosfatgruppen som dannes etter hydrolysen av ATP, er resonansstabilisert. Det vil si at elektronene i Pi kan delokaliseres – de fordeles over flere bindinger i molekylet, noe som gir lavere energi og økt stabilitet.
ATP, derimot, begrenser denne resonansfordelingen når fosfatgruppen er bundet. Derfor er den frie Pi mer stabil alene enn når den er en del av ATP, og dette bidrar til at spaltingen blir energifrigivende.
3. Ionisering av ADP
Når ATP hydrolyseres, dannes ADP²⁻ og Pi²⁻, men i fysiologisk pH (rundt 7) skjer en videre ionisering der ADP mister et proton (H⁺) og blir til ADP³⁻. Denne ioniseringen er energetisk gunstig, fordi det skjer i et miljø hvor H⁺-konsentrasjonen er lav, og systemet «belønnes» energetisk for å bidra med protoner.
Denne ekstra ioniseringen øker stabiliteten til sluttproduktene og bidrar ytterligere til at den totale ΔG blir negativ.
4. Bedre løselighet i vann
Etter hydrolysen er både ADP og Pi bedre løselige i vann enn ATP er. Molekyler som løser seg godt i vann, stabiliseres av hydratisering – vannmolekyler danner skall rundt ionene og senker deres frie energi.
Derfor er sluttproduktene etter hydrolysen energetisk mer stabile også i løsningen, noe som gjør hele prosessen gunstig og energifrigivende.
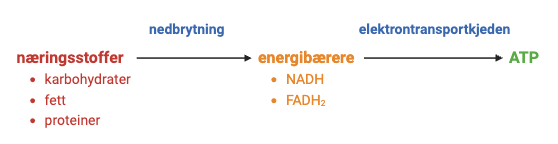
Energi i næringsstoffer og energibærere:
Når vi spiser næringsstoffer som karbohydrater, fett og proteiner, brytes disse ned gjennom katabolske reaksjoner (energigivende reaksjoner). Disse reaksjonene frigir energi.
Energien fra disse næringsstoffene lagres i molekyler som ATP, NADH, NADPH, og FADH₂, som er energibærere.
Produktene fra katabolismen er energifattige molekyler som CO₂, H₂O, og NH₃.
Anabolske reaksjoner (oppbyggingsreaksjoner), derimot, bruker energi for å bygge opp store molekyler som proteiner, polysakkarider, lipider og nukleinsyrer. Disse reaksjonene krever tilførsel av energi og drives av energibærere som ATP og NADH.
Elektrontransport og energifrigjøring
I levende celler handler energioverføring i stor grad om elektronflyt – fra molekyler med lav elektronaffinitet til molekyler med høyere elektronaffinitet. Når elektroner overføres til et molekyl som er mer stabilt, frigjøres energi, og denne energien brukes til å syntetisere ATP, kroppens viktigste energivaluta. Dette skjer i form av redoksreaksjoner, hvor ett molekyl mister elektroner (oksidasjon), mens et annet tar dem opp (reduksjon).
Oksidasjon og reduksjon – to sider av samme mynt
I biokjemien skjer oksidasjon og reduksjon alltid samtidig. Når ett molekyl oksideres og gir fra seg elektroner, må et annet molekyl reduseres og ta imot dem.
- Oksidasjon er tap av elektroner eller hydrogenatomer. Dette skjer i katabolske prosesser – som i nedbrytning av glukose, fettsyrer og aminosyrer – og er ofte energigivende.
- Reduksjon er opptak av elektroner eller hydrogen. Dette skjer i anabole prosesser – som biosyntese av fettsyrer og nukleinsyrer – og er energikrevende.
Et typisk eksempel er enzymet dehydrogenase, som fjerner hydrogenatomer fra et substrat og overfører dem til en elektronbærer. Sluttmålet for mange av disse elektronene er oksygen, som i elektrontransportkjeden tar imot elektroner og danner vann.
Elektronbærere – cellens energitaxi
Når celler bryter ned næringsstoffer for å hente ut energi, frigjøres elektroner.
Disse elektronene bærer med seg høy energi, men de kan ikke flyte fritt rundt i cellen – det ville vært som å sende strøm gjennom et uisolert nettverk.
Derfor finnes det egne molekyler som er spesialisert på å transportere elektroner trygt og effektivt.
Vi kaller dem elektronbærere, og de er helt avgjørende for cellens energimetabolisme.
De tre viktigste elektronbærerne
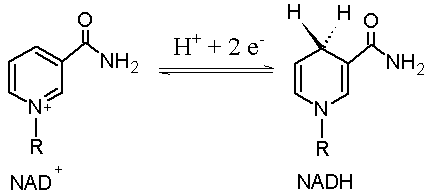
- NAD⁺ – Nikotinamid-adenin-dinukleotid
- FAD – Flavin-adenin-dinukleotid
- NADP⁺ – Nikotinamid-adenin-dinukleotid-fosfat
Disse molekylene fungerer som koenzymer – små hjelpere som binder seg midlertidig til enzymer og deltar aktivt i kjemiske reaksjoner. De tar opp elektroner og protoner fra molekyler som blir oksidert, og bærer dem videre til steder i cellen der elektronene kan brukes – ofte til å generere ATP.
Elektronbærerne gjennomgår redoksreaksjoner – de tar opp elektroner (blir redusert), og gir dem senere fra seg (blir oksidert). Det skjer slik:
- NAD⁺ + 2e⁻ + 2H⁺ → NADH + H⁺
- FAD + 2e⁻ + 2H⁺ → FADH₂
- NADP⁺ + 2e⁻ + 2H⁺ → NADPH + H⁺
De reduserte formene – NADH, FADH₂ og NADPH – inneholder energirike elektroner. NADH og FADH₂ donerer disse elektronene til elektrontransportkjeden i mitokondriene, hvor energi frigjøres og brukes til å produsere ATP. NADPH brukes hovedsakelig i anabole prosesser, som fettsyresyntese og antioksidantforsvar.
Koenzymer og vitaminer
Elektronbærerne har sin opprinnelse i vitaminer, noe som understreker hvor viktig mikronæringsstoffer er for energimetabolismen:
- NAD⁺ og NADP⁺ er avledet fra vitamin B3 (niacin)
- FAD kommer fra vitamin B2 (riboflavin)
Et underskudd på B2 eller B3 vil derfor kunne påvirke hele cellens evne til å produsere energi.
Hovedroller i cellen
- NAD⁺ deltar i katabolske prosesser, som glykolyse og beta-oksidasjon, hvor energirike næringsstoffer brytes ned.
- NADPH brukes i anabole prosesser, som fettsyresyntese og regenerering av glutation, et viktig antioksidantforsvar.
- FADH₂ deltar i spesifikke redoksreaksjoner med høyere energibarrierer og leverer elektroner direkte til kompleks II i elektrontransportkjeden.
Elektronbærerne fungerer som et sirkulerende energisystem:
De tar opp elektroner når substrater oksideres, og gir dem fra seg i reaksjoner som produserer ATP. Når NADH og FADH₂ har levert sine elektroner til elektrontransportkjeden, blir de oksidert tilbake til NAD⁺ og FAD – klare for en ny runde.
Dette gjør dem ikke bare effektive, men også resirkulerbare, og derfor helt essensielle for cellens kontinuerlige energiproduksjon.
📚 Anki-kort
Obs, tomt! Kommer etterhvert <3
📝 Eksamensoppgaver
Obs, tomt! Kommer etterhvert <3
👨⚕️ Klinisk case
Obs, tomt! Kommer etterhvert <3
❓ Test deg selv
Obs, tomt! Kommer etterhvert <3